题目内容
向20mL 0.2mol·L-1 NaOH溶液中,缓缓通入一定量的CO2气体,将溶液在一定条件下蒸干.若得到的固体为纯净物,则通入的CO2在标准状况下的体积为________;写出有关反应的离子方程式________;将上述白色固体加水溶解,加盐酸至pH=7,再蒸干,得到白色固体的质量为________g.
答案:
解析:
提示:
解析:
|
【解答】44.8mL或89.6mL,CO2+2OH-= 【巧解导析】此题应注意两点:①第一次得到的固体为纯净物有两种可能;一是Na2CO3,二是NaHCO3;②第二次得到的固体只有NaCl,可由NaOH求得. |
提示:
|
用NaOH溶液吸收CO2后在一定条件下蒸干可以是常压下加热蒸发至干,也可以是减压条件下在较低温度时蒸干,所以纯净物为NaHCO3是有可能的.由Na+守恒,很容易找出Na+和C原子数之比要么为2∶1(形成Na2CO3),要么为1∶1(形成NaHCO3).由C原子的物质的量等于CO2的物质的量后,求V(CO2);再由Na+数守恒求M(NaCl). |

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
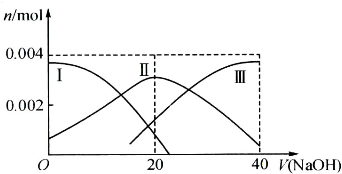
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | C、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | D、向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
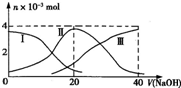 常温下,向20mL 0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表HS
常温下,向20mL 0.2mol?L-1 H2SO3,溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒的物质的量变化曲线如图所示.(其中I代表H2SO3、Ⅱ代表HS| O | - 3 |
| O | 2- 3 |
| A、当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-12?? | ||||
B、当V(NaOH)=20 mL时:c(Na+)>c(HS
| ||||
C、当V(NaOH)=40 mL时2c(Na+)=c(S
| ||||
| D、当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高 |
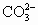 +H2O或CO2+OH-=
+H2O或CO2+OH-=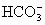 ,0.234g
,0.234g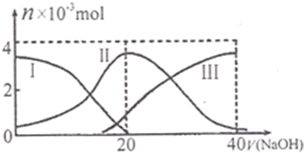
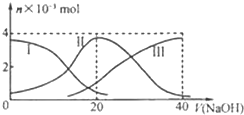 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )