题目内容
下列有关说法正确的是( )
| A、NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 |
| B、镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
| C、加热0.1mol?L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小 |
| D、向0.1mol?L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小 |
考点:盐类水解的原理,金属的电化学腐蚀与防护,焓变和熵变,弱电解质在水溶液中的电离平衡
专题:
分析:A.反应自发进行的判断依据是△H-T△S<0;
B.镀锌铁制品镀层破损在潮湿的空气中形成原电池,锌做负极被腐蚀,镀锡铁铁做负极被腐蚀;
C.加热促进盐的水解;
D.加水稀释促进弱酸的电离.
B.镀锌铁制品镀层破损在潮湿的空气中形成原电池,锌做负极被腐蚀,镀锡铁铁做负极被腐蚀;
C.加热促进盐的水解;
D.加水稀释促进弱酸的电离.
解答:
解:A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,反应△S>0,△H-T△S>0,说明该反应的△H>0,故A错误;
B、镀锌铁制品镀层破损在潮湿的空气中形成原电池,锌做负极被腐蚀,镀锡铁形成原电池,铁做负极被腐蚀,故B错误;
C.加热促进盐的水解,加热0.1mol?L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小,故C正确;
D.向0.1mol?L-1CH3COOH溶液中加水,加水稀释促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,则c(H+)与c(CH3COOH)的比值增大,故D错误.
故选C.
B、镀锌铁制品镀层破损在潮湿的空气中形成原电池,锌做负极被腐蚀,镀锡铁形成原电池,铁做负极被腐蚀,故B错误;
C.加热促进盐的水解,加热0.1mol?L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小,故C正确;
D.向0.1mol?L-1CH3COOH溶液中加水,加水稀释促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,则c(H+)与c(CH3COOH)的比值增大,故D错误.
故选C.
点评:本题考查了自发进行的判断依据、原电池原理的应用、盐的水解、弱酸的电离等,题目难度中等,侧重于有关原理的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将AlCl3、FeCl2、FeCl3、MgCl2四种溶液,只用一种试剂就能加以区别,这种试剂是( )
| A、HCl |
| B、NaOH |
| C、BaCl2 |
| D、KSCN |
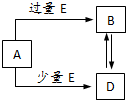 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A、若A是铁,则E可能为稀硝酸 |
| B、若A是CuO,E是碳,则B为CO |
| C、若A是AlCl3溶液,E可能是氨水 |
| D、若A是NaOH溶液,E是CO2,则B为NaHCO3 |
下列说法正确的是( )
| A、KCl和SO3溶于水后都能导电,故KCl和SO3均为电解质 |
| B、相同浓度和体积的强酸与强碱溶液混合后,溶液的pH=7 |
| C、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D、AgCl易转化为AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp(AgCl) |



 请回答下列问题:
请回答下列问题: 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路
的合成路