题目内容
2.已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去.其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物,D是白色胶状沉淀.
请填空:
(1)H的名称是一氧化碳.写出B的电子式
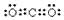
(2)E的重要用途是生产玻璃,制粗硅等
(3)反应③的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(4)反应④的离子方程式是SiO32-+CO2+H2O=H2SiO3↓+CO32-
(5)写出C与溴水反应的离子反应方程式SO2+Br2+2H2O═4H++SO42-+2Cl-.
分析 A为单质,在加热条件下可与浓硫酸反应生成两种气体,且化合物C是一种形成酸雨的大气污染物,则该反应为碳和浓硫酸的反应,生成CO2和SO2,则A为C,B为CO2,C为SO2,A、G为同一主族元素的单质,则G为Si,A与E的反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si,则E为SiO2,H为CO,F为Na2SiO3,D为H2SiO3,结合物质的性质和应用解答该题.
解答 解:(1)由以上分析可知H为CO,名称为一氧化碳,B为CO2,电子式为: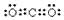 ,故答案为:一氧化碳;
,故答案为:一氧化碳;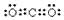 ;
;
(2)E为SiO2,常用于制备玻璃、制粗硅、光导纤维等,故答案为:生产玻璃,制粗硅等;
(3)反应③为C和浓硫酸的反应,方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)反应④为Na2SiO3溶液和二氧化碳的反应,反应的方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(5)C为SO2,与溴水发生氧化还原反应生成硫酸和氯化氢,离子反应方程式为SO2+Br2+2H2O═4H++SO42-+2Cl-,故答案为:SO2+Br2+2H2O═4H++SO42-+2Cl-.
点评 本题考查无机物的推断,题目难度不大,本题以A与浓硫酸且生产导致酸雨的气体为突破口,答题时注意把握相关物质的性质及应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.物质的鉴别有多种方法.下列能达到鉴别目的是( )
①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 ③点燃鉴别甲烷
和乙烯 ④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用碳酸钠溶液鉴別酒精、醋酸、油脂.
①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 ③点燃鉴别甲烷
和乙烯 ④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用碳酸钠溶液鉴別酒精、醋酸、油脂.
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ①②③ |
19.如图所示的实验操作,不能达到相应目的是( )
| A. |  吸收NH3 | B. |  检验K2CO3中的K+ | ||
| C. |  证明氨气极易溶于水 | D. |  实验室制氨气 |
10.下列各组热化学方程式中,△H1>△H2的是( )
| A. | C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2 |
17.化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 煤是混合物,含有大量的芳香烃 |
14.LiFePO4新型锂离子动力电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.已知该电池放电时的电极反应式为:正极:FePO4+Li++e-═LiFePO4,负极:Li-e-═Li+.下列说法正确的是( )
| A. | 充电时电池反应式为FePO4+Li═LiFePO4 | |
| B. | 放电时在正极上是Li+得电子被还原 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 充电时动力电池上“+”的电极与外接电源的负极相连 |
11. 短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )
短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )
 短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )
短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )| A. | 元素的非金属性:Y>Z>X | |
| B. | 反应①中消耗lmola时转移电子数与反应②中生成1mol a时转移电子数相等 | |
| C. | 原子半径的大小:y<Z<W | |
| D. | Y的氢化物常温常压下为气态 |
14.下列关于金属钠的叙述中不正确的是( )
| A. | 钠具有良好的导电性,密度比水的小 | |
| B. | 钠在空气中最后变为白色的碳酸钠 | |
| C. | Ca(OH)2饱和溶液中加入Na的小颗粒,会析出固体 | |
| D. | 钠在工业上用于制造氯化钠、氢氧化钠、碳酸钠等化合物 |