题目内容
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力。按要求回答下列问题。
(1) 现有下列短周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方: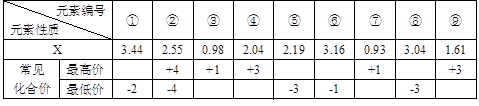
写出下列编号所代表的元素符号:①____,②____,④____,⑤____,⑥____。
(2) 已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: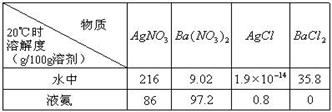
由上表的数据可知,在水溶液中上述化合物发生复分解反应的化学方程式为______________________,在液氨溶液中发生复分解反应的化学方程式为______________________________________________。
(3) 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。三种物质和铁发生反应的顺序为___________,第一步反应的离子方程式为________,由图可知溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为__________。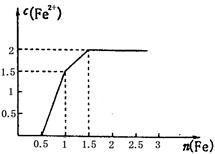
(1)(5分,每空1分)O;C;B;P;Cl。
(2)2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2;2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓
(3)HNO3、Fe(NO3)3、Cu(NO3)2; Fe+4H++NO3-=Fe3++NO↑+2H2O ;1:1:4
解析试题分析:(1)根据题意可知若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方,这说明X值越大,非金属性越强。①的最低价是-2价,没有最高价,且X值最大,这说明X应该是位于第二周期第ⅥA族的氧元素;②的最高价和最低价分别是+4价和-4价,这说明②是第ⅣA族元素。④和⑨的最高价是+3价,因此是第ⅢA族所以。由于X值是④>⑨,所以④是B,⑨是Al。⑤⑧的最低价均是-3价,说明二者是第ⅤA族所以。由于X值是⑧>⑤,所以⑤是P,⑧N。⑥的最低价是-1价,说明位于第ⅦA族,且X值仅小于氧元素的,因此⑥是氯元素。③⑦的最高价是+1价,说明是第IA族元素。由于X值是③>⑦,所以③是Li,⑦是钠。由于②的X值大于P元素的,而小于N元素的,这说明②元素第二周期的碳元素。
(2)根据物质的溶解度表可分析物质在不同溶剂中的溶解度,再利用复分解反应发生的条件来判断发生的化学反应。因在水中,AgCl的溶解度为1.9×10-4g,则可认为氯化银不溶于水,其它三种物质都能溶于水,因此氯化钡和硝酸银能相互交换成分生成氯化银沉淀而发生了复分解反应,其反应为BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓;在液氨中,BaCl2的溶解度接近0,则可认为氯化钡在液氨中不溶,其它物质都能溶解在液氨中,因此硝酸钡和氯化银能相互交换成分生成氯化钡沉淀而发生复分解反应,其反应为2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓。
(3)稀溶液中各物质的氧化性顺序为HNO3>Fe(NO3)3>Cu(NO3)2,所以加入铁后会依次发生氧化还原反应,①Fe+4H++NO3-=Fe3++NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+,所以三种物质和铁发生反应的顺序为HNO3、Fe(NO3)3、Cu(NO3)2;从图象中可知铁为0.5mol时,无Fe2+生成,发生的反应是①,消耗硝酸为0.5mol×4=2mol,生成Fe3+0.5mol;再加入0.5mol铁发生反应②,生成Fe2+物质的量为1.5mol,反应的Fe3+物质的量为1mol,其中原溶液中的Fe3+物质的量0.5mol;再加入0.5mol铁发生反应③,此时又生成Fe2+物质的量为0.5mol,说明原溶液中Cu2+物质的量为0.5mol.综上所述可知原溶液中Fe(NO3)3为0.5mol,Cu(NO3)2物质的量为0.5mol,HNO3物质的量为2mol,因此溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4。
考点:考查元素周期律的应用;复分解反应判断以及方程式的书写;氧化还原反应的有关判断和计算

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为________________________;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为______________________。
(2)请以FeSO4溶液、KI溶液、氯水、2% KSCN为试剂证明I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 | 现象:溶液变成黄色。 结论: 。 |
| 步骤2:__________________________ __________________________________ | 现象: ; 结论: |
(3)利用 中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, 。
(4)向含2mol FeI2溶液中通入2.5mol Cl2时,请写出总的离子方程式: 。
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 mo1/L 。
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: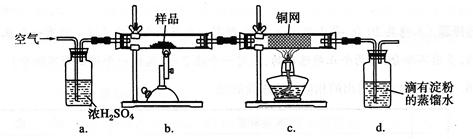

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(4)滴定时,标准碘溶液所耗体积为 mL。用化学方程式表示滴定的原理: 。
(5)通过计算可知,该黄铜矿的纯度为 。