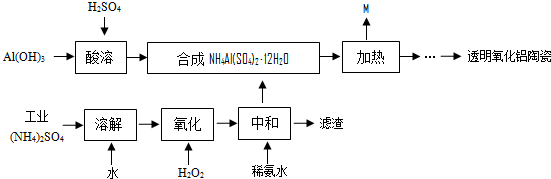
题目内容
在(NH4)2SO4中加入足量的NaOH溶液,加热,充分反应后产生4.48L气体(标准状况),求(NH4)2SO4的质量.如将所得氨气完全溶解在1L水中(溶解前后溶液体积变化忽略不计),求所得氨水溶液的质量分数和物质的量浓度
3.3%;0.2mol/L
3.3%;0.2mol/L
.分析:根据n=
计算生成氨气的物质的量,根据氮元素守恒可知n[(NH4)2SO4]=
n(NH3),再根据m=nM计算(NH4)2SO4的质量;
根据m=nM计算氨气的质量,根据m=ρV计算水的质量,根据ω=
×100%计算所得氨水的质量分数;
根据c=
计算所得氨水的物质的量浓度.
| V |
| Vm |
| 1 |
| 2 |
根据m=nM计算氨气的质量,根据m=ρV计算水的质量,根据ω=
| m(氨气) |
| m(氨气)+m(水) |
根据c=
| n |
| V |
解答:解:(1)(NH4)2SO4与NaOH溶液反应生成氨气为4.48L,则氨气的物质的量=
=0.2mol,
根据氮元素守恒可知n[(NH4)2SO4]=
n(NH3)=
×0.2mol=0.1mol,
故(NH4)2SO4的质量=0.1mol×132g/mol=13.2g,
答:(NH4)2SO4的质量为13.2g.
(2)ω(氨气)=
×100%=3.3%,
c(氨水)=
=0.2mol/L,
故答案为:3.3%;0.2mol/L.
| 4.48L |
| 22.4L/mol |
根据氮元素守恒可知n[(NH4)2SO4]=
| 1 |
| 2 |
| 1 |
| 2 |
故(NH4)2SO4的质量=0.1mol×132g/mol=13.2g,
答:(NH4)2SO4的质量为13.2g.
(2)ω(氨气)=
| 0.2mol×17g/mol |
| 0.2mol×17g/mol+1000mL×1g/mL |
c(氨水)=
| 0.2mol |
| 1L |
故答案为:3.3%;0.2mol/L.
点评:本题考查常用根据方程式的有关计算、物质的量浓度计算、质量分数计算等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
下列各项中的两个量,其比值一定为2:1的是( )
| A、液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积 | ||||
| B、相同温度下,0.2mol?L-1醋酸溶液和0.1mol?L-1醋酸溶液中的c(H+) | ||||
C、在(NH4)2SO4溶液中,c(NH
| ||||
| D、相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-) |