题目内容
(2012?南京模拟)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:
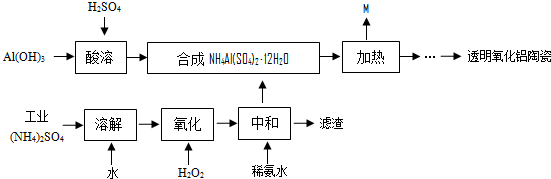
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为
(2)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为
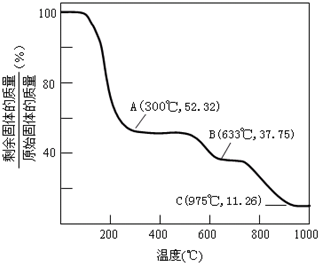
(3)固体NH4Al(SO4)2?12H2O在加热时,固体残留率随温度的变化如上图所示.633℃时剩余固体的成分化学式为
(4)综上分析,流程图中M的主要成分的化学式为

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.在(NH4)2SO4溶液中,存在NH4++H2O?NH3?H2O+H+,该反应的平衡常数表达式为K=K=
| c(H+)?c(NH3?H2O) |
| c(NH4+) |
K=
.| c(H+)?c(NH3?H2O) |
| c(NH4+) |
(2)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为
NH4Al(SO4)2+5NaOH
NH3↑+3H2O+NaAlO2+2Na2SO4
| ||
NH4Al(SO4)2+5NaOH
NH3↑+3H2O+NaAlO2+2Na2SO4
.
| ||

(3)固体NH4Al(SO4)2?12H2O在加热时,固体残留率随温度的变化如上图所示.633℃时剩余固体的成分化学式为
Al2(SO4)3
Al2(SO4)3
.(4)综上分析,流程图中M的主要成分的化学式为
NH3、H2O、SO3
NH3、H2O、SO3
,M可用一种物质吸收以实现循环利用,该物质的名称是浓硫酸或水
浓硫酸或水
.分析:(1)、硫酸铵中含有硫酸亚铁,亚铁离子被双氧水氧化成铁离子2Fe2++H2O2+2H+=2Fe3++2H2O;根据化学平衡常数表达式写出该反应的平衡常数的表达式;
(2)、NH4Al(SO4)2溶液与过量NaOH溶液反应生成氨气和偏铝酸钠,NH4Al(SO4)2+5NaOH
NH3↑+3H2O+NaAlO2+2Na2SO4;
(3)、633℃时剩余固体质量分数是反应前的37.75%,根据硫酸铝铵晶体分解情况分析,得出化学式;
(3)、633℃时剩余固体质量分数是反应前的37.75%,根据硫酸铝铵晶体分解情况分析,得出化学式;
(4)、M的主要成分的化学式是NH3、H2O、SO3 ;可以用水或者浓硫酸吸收生成硫酸铵,以便重复利用.
(2)、NH4Al(SO4)2溶液与过量NaOH溶液反应生成氨气和偏铝酸钠,NH4Al(SO4)2+5NaOH
| ||
(3)、633℃时剩余固体质量分数是反应前的37.75%,根据硫酸铝铵晶体分解情况分析,得出化学式;
(3)、633℃时剩余固体质量分数是反应前的37.75%,根据硫酸铝铵晶体分解情况分析,得出化学式;
(4)、M的主要成分的化学式是NH3、H2O、SO3 ;可以用水或者浓硫酸吸收生成硫酸铵,以便重复利用.
解答:解:(1)、亚铁离子被氧化双氧水成铁离子,根据化合价升降相等配平方程式,离子方程式是:2Fe2++H2O2+2H+=2Fe3++2H2O;根据化学反应平衡常数表达式,写成该反应的平衡常数表达式,该反应的平衡常数表达式为K=
;
故答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;
;
(2)、NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为:NH4Al(SO4)2+5NaOH
NH3↑+3H2O+NaAlO2+2Na2SO4
故答案是:NH4Al(SO4)2+5NaOH
NH3↑+3H2O+NaAlO2+2Na2SO4;
(3)、假设有1mol硫酸铝铵晶体,摩尔质量是453g/mol,质量是453g,最后得到的是氧化铝,硫酸铝铵晶体加热过程中会分解,分别生成了水、氨气、三氧化硫;
当结晶水完全失去时,剩余固体与原始固体的质量百分比是:
×100%≈52.32%,大于这个值,说明结晶水没有完全失去;
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:
×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解;故B点剩余固体是硫酸铝;
故答案是:Al2(SO4)3
(4)、综上分析,流程图中M的主要成分的化学式为NH3、H2O、SO3 ;可以用水或者浓硫酸吸收生成硫酸铵重复使用;
故答案是:NH3、H2O、SO3 ; 浓硫酸或水.
| c(H+)?c(NH3?H2O) |
| c(NH4+) |
故答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;
| c(H+)?c(NH3?H2O) |
| c(NH4+) |
(2)、NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为:NH4Al(SO4)2+5NaOH
| ||
故答案是:NH4Al(SO4)2+5NaOH
| ||
(3)、假设有1mol硫酸铝铵晶体,摩尔质量是453g/mol,质量是453g,最后得到的是氧化铝,硫酸铝铵晶体加热过程中会分解,分别生成了水、氨气、三氧化硫;
当结晶水完全失去时,剩余固体与原始固体的质量百分比是:
| 18×12 |
| 453 |
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:
| 171 |
| 453 |
故答案是:Al2(SO4)3
(4)、综上分析,流程图中M的主要成分的化学式为NH3、H2O、SO3 ;可以用水或者浓硫酸吸收生成硫酸铵重复使用;
故答案是:NH3、H2O、SO3 ; 浓硫酸或水.
点评:本题考查了以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的方法,关键提分析、理解题中信息,根据所学化学知识完成,本题难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目





 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).