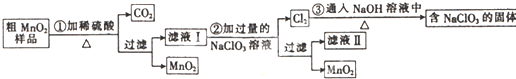
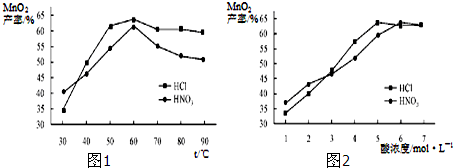
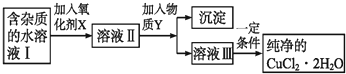
题目内容
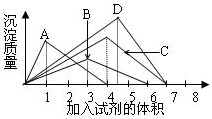 如图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应曲线变化关系的实验项( )
如图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应曲线变化关系的实验项( )| A、硝酸银溶液中加入氨水溶液 |
| B、往澄清石灰水中逐渐通入CO2气体 |
| C、往AlCl3溶液中逐NaOH溶液 |
| D、往NaAlO2溶液中逐滴加入盐酸溶液 |
考点:氨的化学性质,镁、铝的重要化合物
专题:图示题
分析:A.硝酸银溶液中加入氨水溶液,开始生成AgOH沉淀,氨水过量,发生络合反应生成银氨络离子,沉淀溶解;
B.往澄清石灰水中逐渐通入CO2气体,先生成碳酸钙沉淀,二氧化碳过量生成碳酸氢钙,沉淀溶解;
C.往AlCl3溶液中逐NaOH溶液,先生成氢氧化铝沉淀,氢氧化钠过量生成偏铝酸钠;
D.往NaAlO2溶液中逐滴加入盐酸溶液,先生成氢氧化铝,盐酸过量生成氯化铝.
B.往澄清石灰水中逐渐通入CO2气体,先生成碳酸钙沉淀,二氧化碳过量生成碳酸氢钙,沉淀溶解;
C.往AlCl3溶液中逐NaOH溶液,先生成氢氧化铝沉淀,氢氧化钠过量生成偏铝酸钠;
D.往NaAlO2溶液中逐滴加入盐酸溶液,先生成氢氧化铝,盐酸过量生成氯化铝.
解答:
解:A.硝酸银溶液中加入氨水溶液,开始生成AgOH沉淀,发生NH3?H2O+AgNO3=AgOH↓+NH4NO3,氨水过量,发生络合反应生成银氨络离子,沉淀溶解,发生AgOH+2NH3?H2O=Ag(NH3)2OH+2H2O,前后消耗的氨水的体积比为1:2,故A错误;
B.往澄清石灰水中逐渐通入CO2气体,先生成碳酸钙沉淀,发生Ca(OH)2+CO2=CaCO3↓+H2O,二氧化碳过量生成碳酸氢钙,沉淀溶解,发生CaCO3+CO2+H2O=Ca(HC3)2,两个反应消耗的二氧化碳的体积比为1:1,图象符合,故B正确;
C.AlCl3中加入NaOH先生成Al(OH)3,发生Al3++3OH-═Al(OH)3↓,Al(OH)3具有两性,继续加入NaOH溶液则发生Al(OH)3+OH-═AlO2-+2H2O,两个反应消耗的氢氧化钠的体积之比为3:1,图象不符,故C错误;
D.往NaAlO2溶液中逐滴加入盐酸溶液,先生成氢氧化铝,发生AlO2-+H++H2O=Al(OH)3↓,盐酸过量生成氯化铝,发生Al(OH)3+3H+═Al3++3H2O,二者消耗盐酸的体积比为1:3,图象不符,故D错误.
故选B.
B.往澄清石灰水中逐渐通入CO2气体,先生成碳酸钙沉淀,发生Ca(OH)2+CO2=CaCO3↓+H2O,二氧化碳过量生成碳酸氢钙,沉淀溶解,发生CaCO3+CO2+H2O=Ca(HC3)2,两个反应消耗的二氧化碳的体积比为1:1,图象符合,故B正确;
C.AlCl3中加入NaOH先生成Al(OH)3,发生Al3++3OH-═Al(OH)3↓,Al(OH)3具有两性,继续加入NaOH溶液则发生Al(OH)3+OH-═AlO2-+2H2O,两个反应消耗的氢氧化钠的体积之比为3:1,图象不符,故C错误;
D.往NaAlO2溶液中逐滴加入盐酸溶液,先生成氢氧化铝,发生AlO2-+H++H2O=Al(OH)3↓,盐酸过量生成氯化铝,发生Al(OH)3+3H+═Al3++3H2O,二者消耗盐酸的体积比为1:3,图象不符,故D错误.
故选B.
点评:本题查离子反应与图象关系、化学计算等,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质,把握与量有关的反应,难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
将标准状况下密度为ρg/L的HCl气体V L溶于1000g水中,得到密度为b g/cm3的盐酸,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
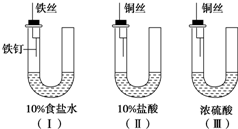 某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )
某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )| A、装置Ⅰ的U形管铁钉一侧的液面一定会上升 |
| B、装置Ⅱ中的铁钉腐蚀最严重 |
| C、比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低 |
| D、装置Ⅲ中的铁钉几乎没有被腐蚀 |