��Ŀ����
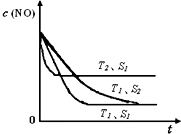
��9�֣����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣T��ʱ��Ӧ2SO2(g)+O2(g) 2SO3(g)�����е������仯��ͼ��ʾ���ش��������⡣
2SO3(g)�����е������仯��ͼ��ʾ���ش��������⡣
(1)T��ʱ��3molSO2��1molO2ͨ�����Ϊ2L�ĺ��º����ܱ������У�������Ӧ��2minʱ��Ӧ�ﵽƽ�⣬��ʱ��÷�Ӧ��O2��ʣ��0.1mol , ��ﵽƽ��ʱSO2��ת����Ϊ ��(1��)
(2)����������֤���÷�Ӧ�Ѵﻯѧƽ��״̬���� ������ţ�(2��)
��SO2������������ٷ����仯 ��������ѹǿ���ٷ����仯 ����������������������ٷ����仯 ����ͬʱ��������2n molSO2��ͬʱ����n molO2 ����ͬʱ��������2n molSO2��ͬʱ����2n molSO3
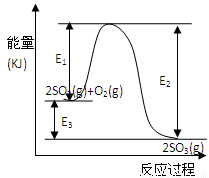
(3) ��Ӧ ����ų��������ա��� ��������E1��E2��E3��ʾ��(2��)��
(4)������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬ��SO2��O2��һ��ѹǿ�絽���Ե缫�Ϸ�Ӧ��
д�����缫�ĵ缫��Ӧʽ��
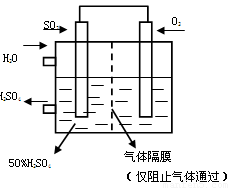
�� ��(2��) [����]Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ (2��)
��1��60%(1��) ��2���٢ڢۢ�(2��)
��3�����ȣ� E3 ��E2- E1��(2��)
��4������O2��4e����4H�� 2H2O(1��)
2H2O(1��)
����2SO2��4e����4H2O 2SO42����8H�� (1��) 16:
29(2��)
2SO42����8H�� (1��) 16:
29(2��)
��������

 ���ݼ���ϵ�д�
���ݼ���ϵ�д���1����֪1.0mol��L��1NaHSO3��Һ��pHΪ3.5�������Һ����Ũ�ȴӴ�С��˳��Ϊ �������ӷ��ű�ʾ����
 ��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O
��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O![]() HSO3��+OH������ʵ�� ������ţ���
HSO3��+OH������ʵ�� ������ţ���
A�������̪��Һ��죬�ټ���H2SO4��Һ��ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ڼ���BaCl2��Һ����������Һ�ɫ��ȥ
��3����ҵ�����ô�������Ӧ��SO2ת��ΪSO3��2SO2+ O2 ![]() 2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
��4����������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijͬѧ���ʵ�����±���ʾ��
| 0.01mol��L��1 KIO3 ������Һ(������)�����/mL | 0.01mol��L��1 Na2SO3 ��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s | |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 |
����V2=___________mL����ʵ���Ŀ����______________ ______��
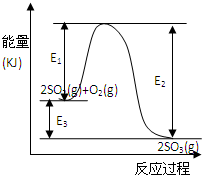 ���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮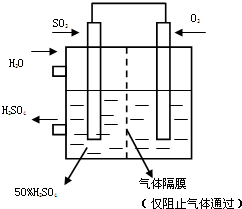
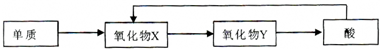

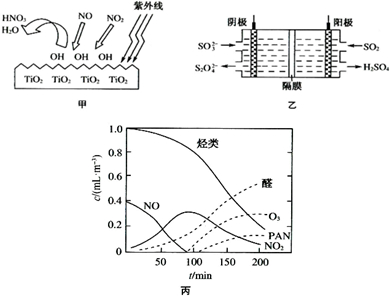
 ���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�
���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�