题目内容
下列有关金属腐蚀与防护的说法正确的是( )
| A、钢铁在空气中的腐蚀主要是化学腐蚀 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D、可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |
考点:金属的电化学腐蚀与防护
专题:
分析:A.钢铁的腐蚀主要是析氢腐蚀和吸氧腐蚀;
B.Fe、Sn形成原电池时,Fe为负极;
C.Fe、Zn形成原电池时,Fe为正极;
D.Fe与正极相连作阳极,被腐蚀.
B.Fe、Sn形成原电池时,Fe为负极;
C.Fe、Zn形成原电池时,Fe为正极;
D.Fe与正极相连作阳极,被腐蚀.
解答:
解:A.钢铁的腐蚀主要是析氢腐蚀和吸氧腐蚀,属于电化学腐蚀,故A错误;
B.Fe、Sn形成原电池时,Fe为负极,负极失电子被腐蚀,所以当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用,故B错误;
C.Fe、Zn形成原电池时,Fe为正极,Zn为负极失电子,则Fe被保护,属于牺牲阳极的阴极保护法,故C正确;
D.Fe与正极相连作阳极,活性电极作阳极时,电极失电子被腐蚀,则地下输油管与外加直流电源的负极相连以保护它不受腐蚀,故D错误.
故选C.
B.Fe、Sn形成原电池时,Fe为负极,负极失电子被腐蚀,所以当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用,故B错误;
C.Fe、Zn形成原电池时,Fe为正极,Zn为负极失电子,则Fe被保护,属于牺牲阳极的阴极保护法,故C正确;
D.Fe与正极相连作阳极,活性电极作阳极时,电极失电子被腐蚀,则地下输油管与外加直流电源的负极相连以保护它不受腐蚀,故D错误.
故选C.
点评:本题考查金属的腐蚀与防护,题目难度不大,注意把握金属腐蚀的原理和原电池原理、电解池原理.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、17gNH3所含质子数目为7 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol?/L的MgCl2溶液中,含有Cl- 个数为1 NA |
地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是( )
| A、熔点很高 |
| B、与水反应生成对应的酸 |
| C、可与烧碱反应生成盐 |
| D、坚硬 |
电解质和非电解质是对化合物的一种分类方式.下列关于电解质的说法正确的是( )
| A、液态HCl不导电,所以HCl不是电解质 |
| B、NH3溶于水形成的溶液能导电,所以NH3是电解质 |
| C、电解质一定能导电,能导电的物质一定属于电解质 |
| D、AgCl在水溶液中难导电,但熔融状态下能导电,所以AgCl是电解质 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、64 g SO2含有氧原子数为1NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数目为1 NA |
| C、标准状况下,22.4 L H2O的分子数为1N |
| D、常温常压下,14 g N2含有分子数为0.5 NA |
下列两种气体的原子数一定相等的是( )
| A、质量相等、密度不等的N2和C2H4 |
| B、等体积等密度的CO和N2 |
| C、等温等体积的O2和Cl2 |
| D、等压等体积的NH3和CO2 |
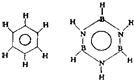 巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( ) 1mol C6H6与H2加成时:Ⅰ需
1mol C6H6与H2加成时:Ⅰ需 立体结构:该结构的二氯代物有
立体结构:该结构的二氯代物有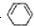 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯