题目内容
16.配制500mL 0.1mol/L的NaCl溶液,下列说法或操作正确的是( )| A. | 用托盘天平准确称量干燥的NaCl固体2.925 g | |
| B. | 准确称量2.9 g NaCl固体溶于500 mL蒸馏水 | |
| C. | 在500 mL 容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线 | |
| D. | 正确称量2.9 g混有KCl的NaCl固体,其他操作均正确,配好后的溶液中c(Cl-)偏低 |
分析 A.托盘天平精确到0.1;
B.溶液的体积不是500mL;
C.容量瓶不能溶解固体;
D.混有KCl的NaCl固体,氯化钠的质量偏低.
解答 解:A.托盘天平精确到0.1,无法称量2.925 g,故A错误;
B.2.9 g NaCl固体溶于500 mL蒸馏水,溶液的体积不是500mL,故B错误;
C.容量瓶不能溶解固体,应在烧杯中溶解固体,故C错误;
D.混有KCl的NaCl固体,氯化钠的质量偏低,浓度偏低,故D正确.
故选D.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,学会分析错误操作对溶质的质量和溶液体积造成的影响是解题关键,属于基础型题目,难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
7.下列气体的主要成分不是甲烷的是( )
①空气 ②沼气 ③天然气 ④水煤气 ⑤坑气 ⑥石油液化气.
①空气 ②沼气 ③天然气 ④水煤气 ⑤坑气 ⑥石油液化气.
| A. | ①②④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①④⑥ |
11.下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中不正确的是( )
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3可以相互转化 |
1.下列各溶液中能大量共存的离子组是( )
| A. | 碳酸氢钠溶液中:K+、NO3-、Cl-、H+ | |
| B. | 使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| C. | 澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl-- | |
| D. | 使石蕊试液变红的溶液中:Na+、Cl-、K+、CH3COO- |
8.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
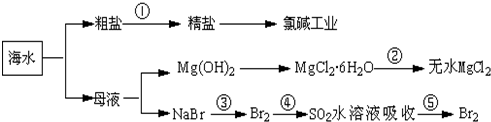

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程④中SO2被还原 | |
| C. | 从第③步到第⑤步的目的是为了浓缩 | |
| D. | 从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
5.下列关于12C和13C微粒的说法中正确的是( )
| A. | 它们是同种元素 | B. | 它们的化学性质不同 | ||
| C. | 它们是同位素关系 | D. | 它们是同种原子 |
14.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为温度越低,碳酸氢钠的溶解度越小,便于析出.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在A与B装置之间(填写字母)连接一个盛有饱和NaHCO3溶液 的洗气装置,其作用是除去CO2中混合的HCl气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.