题目内容
4.人早晨不吃早餐,血糖会降低.一个人早晨吃了一个馒头,现从此人的消化道中取一些液体.(1)对液体进行一些处理后,加入银氨溶液,在合适的条件下,产生了银镜现象,能否说明淀粉已完全水解?为什么?产生银镜反应只能说明淀粉产生了水解,但不能说明已水解完全,如果再加碘水溶液不变蓝,则可以说明淀粉已水解完全
(2)如果反应需要1mol银氨离子,则反应消耗了0.5mol葡萄糖.
分析 (1)淀粉的水解产物是葡萄糖,发生银镜反应说明淀粉水解有葡萄糖生成;
(2)1mol葡萄糖中含1mol羟基,而1mol羟基能消耗2mol银氨溶液,据此分析.
解答 解:(1)淀粉的水解产物是葡萄糖,发生银镜反应说明淀粉已开始水解、并有葡萄糖生成,但不能说明淀粉已水解完全,要想检验淀粉是否水解完全,只需要向溶液中加入碘水,观察是否变蓝即可,
故答案为:产生银镜反应只能说明淀粉产生了水解,但不能说明已水解完全,如果再加碘水溶液不变蓝,则可以说明淀粉已水解完全;
(2)1mol葡萄糖中含1mol羟基,而1mol羟基能消耗2mol银氨溶液,即1mol葡萄糖~2mol银氨溶液,故当反应需要1mol银氨溶液时,则说明葡萄糖的物质的量为0.5mol,故答案为:0.5.
点评 本题考查了淀粉的水解程度的检验和淀粉水解产物葡萄糖的银镜反应,难度不大,应注意的是有葡萄糖生成并不能说明淀粉水解完全.

练习册系列答案
相关题目
15.下列实验操作或实验所得出的结论一定正确的是( )
| A. | 加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 把氢氧化钠固体在烧杯中溶解后立即转移到容量瓶中,然后加水定容 | |
| C. | 除去蛋白质中混有的少量NaCl,加入AgNO3溶液后过滤 | |
| D. | 把装有二氧化氮和四氧化氮混合气体的烧瓶浸入到热水中气体颜色加深 |
12. 为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
 为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )| A. | 负极反应式:Ag+Cl-e-=AgCl | |
| B. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| C. | Na2Mn5O10是还原产物 | |
| D. | Cl-不断向电池的正极移动 |
19.医生建议患甲状腺肿大的病人多吃海带,这是由于海带中含较丰富的( )
| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
9.下列有关焰色反应叙述正确的是( )
| A. | 可用洁净的铁丝代替铂丝进行焰色反应 | |
| B. | 焰色反应是金属单质的特性 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 氯化钠在火焰上灼烧时火焰呈紫色 |
16.配制500mL 0.1mol/L的NaCl溶液,下列说法或操作正确的是( )
| A. | 用托盘天平准确称量干燥的NaCl固体2.925 g | |
| B. | 准确称量2.9 g NaCl固体溶于500 mL蒸馏水 | |
| C. | 在500 mL 容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线 | |
| D. | 正确称量2.9 g混有KCl的NaCl固体,其他操作均正确,配好后的溶液中c(Cl-)偏低 |
13. 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 | |
| B. | 充电时,A为阴极,发生还原反应 | |
| C. | 放电时,B为正极,电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
2.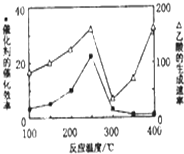 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
①t min内CO2的平均反应速率为$\frac{1}{t}$mol•L-1•min-1.此温度下该反应的平衡常数K=64
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.