题目内容
下列方程式中(以下填写序号)
①CaCO3(s) = CaO + CO2(g);ΔH= 177.7kJ/mol
②C(s) + H2O(g)= CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) =0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) =CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(s) = CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) =NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) =2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有________
(2)根据上述信息,写出C转化为CO的热化学方程式________。
(3)上述反应中,表示燃烧热的热化学方程式有________;
表示中和热的热化学方程式有________
①②③⑦ C(s) + 1/2 O2(g) ="=" CO (g) ΔH=-110.5kJ/mol ④⑤ ⑥
(1)①中没有注明物质的状态,不正确;碳和水蒸气反应是吸热反应,△H大于0,②不正确;③不正确,物质的状态不正确,应该是0.5H2SO4(ag) + NaOH(ag) = 0.5Na2SO4(ag) + H2O(l);ΔH= -57.3kJ/mol;⑦不正确,反应热的数值是错误的,其余都是正确的,所以答案选①②③⑦。
(2)根据盖斯定律可知,④-⑤即得到C(s) + 1/2 O2(g) = CO (g),所以反应热ΔH=-393.5kJ/mol+283kJ/mol=-110.5kJ/mol。
(3)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,因此表示燃烧热的是④⑤;中和热是在一定条件下,再稀溶液中,酸和碱反应生成1mol水水所放出的热量,所以答案是⑥。
(1)①中没有注明物质的状态,不正确;碳和水蒸气反应是吸热反应,△H大于0,②不正确;③不正确,物质的状态不正确,应该是0.5H2SO4(ag) + NaOH(ag) = 0.5Na2SO4(ag) + H2O(l);ΔH= -57.3kJ/mol;⑦不正确,反应热的数值是错误的,其余都是正确的,所以答案选①②③⑦。
(2)根据盖斯定律可知,④-⑤即得到C(s) + 1/2 O2(g) = CO (g),所以反应热ΔH=-393.5kJ/mol+283kJ/mol=-110.5kJ/mol。
(3)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,因此表示燃烧热的是④⑤;中和热是在一定条件下,再稀溶液中,酸和碱反应生成1mol水水所放出的热量,所以答案是⑥。

练习册系列答案
相关题目
(14分))某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
6.34 |
9.7 |
|
Fe3+ |
1.48 |
3.2 |
|
Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。
[Fe(OH)3的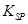 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
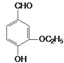 是食品添加剂的增香原料,其香味比香草醛更加浓郁.
是食品添加剂的增香原料,其香味比香草醛更加浓郁.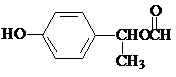 或
或
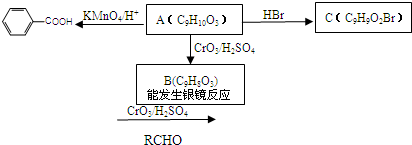
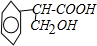

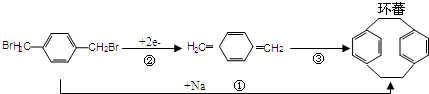
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.





