题目内容
煤燃烧的反应热可通过以下两个途径来利用:
Ⅰ.利用煤在充足的空气中直接燃烧产生的反应热;
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.
这两个过程的热化学方程式为:
Ⅰ.C(s)+O2(g)═CO2(g)△H=E1①
Ⅱ.C(s)+H2Og)═CO(g)+H2(g)△H=E2②
H2(s)+
O2(g)═H2O(g)△H=E3③
CO(s)+
O2(g)═CO2(g)△H=E4④
请填写下列空白:
(1)已知下列热化学方程式:
①H2(s)+
O2(g)=H2O(g)△H=-241.8kJ/mol
②C(s)+
O2(g)=CO(s)△H=-110.5kJ/mol
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO(g)△H=
(2)在上述四个热化学方程式中,
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量正确的关系是(填序号)
A.I比Ⅱ多 B.I比Ⅱ少 C.I与Ⅱ在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
Ⅰ.利用煤在充足的空气中直接燃烧产生的反应热;
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.
这两个过程的热化学方程式为:
Ⅰ.C(s)+O2(g)═CO2(g)△H=E1①
Ⅱ.C(s)+H2Og)═CO(g)+H2(g)△H=E2②
H2(s)+
| 1 |
| 2 |
CO(s)+
| 1 |
| 2 |
请填写下列空白:
(1)已知下列热化学方程式:
①H2(s)+
| 1 |
| 2 |
②C(s)+
| 1 |
| 2 |
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO(g)△H=
131.3KJ/mol
131.3KJ/mol
(2)在上述四个热化学方程式中,
②
②
(填编号)反应的△H>0;(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量正确的关系是(填序号)
C
C
;A.I比Ⅱ多 B.I比Ⅱ少 C.I与Ⅱ在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
E1=E2+E3+E4
E1=E2+E3+E4
.分析:(1)固体燃料变为气体燃料,能源利用率高,污染小;
(2)燃烧反应均为放热反应,C与水蒸气的反应为吸热反应;
(3)根据盖斯定律可知,反应一步完成或分步完成,其热效应相同;
(4)利用盖斯定律来分析.
(2)燃烧反应均为放热反应,C与水蒸气的反应为吸热反应;
(3)根据盖斯定律可知,反应一步完成或分步完成,其热效应相同;
(4)利用盖斯定律来分析.
解答:解:(1)已知:①H2(s)+
O2(g)=H2O(g)△H=-241.8kJ/mol②C(s)+
O2(g)=CO(s)△H=-110.5kJ/mol,根据盖斯定律,则反应C(s)+H2O(g)=H2(g)+CO(g)可以通过②-①得到,所以反应的焓变△H=-110.5kJ/mol-(-241.8kJ/mol)=131.3KJ/mol,故答案为:131.3KJ/mol;
(2)①③④为燃烧反应,所以放热反应,②为吸热反应,故答案为:②;
(3)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,则等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同,
故答案为:C; (4)由盖斯定律可知,①=②+③+④,则能量为E1=E2+E3+E4,故答案为:E1=E2+E3+E4.
| 1 |
| 2 |
| 1 |
| 2 |
(2)①③④为燃烧反应,所以放热反应,②为吸热反应,故答案为:②;
(3)由盖斯定律可知,反应一步完成或分步完成,其热效应相同,则等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同,
故答案为:C; (4)由盖斯定律可知,①=②+③+④,则能量为E1=E2+E3+E4,故答案为:E1=E2+E3+E4.
点评:本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,题目较简单,注重基础知识的考查.

练习册系列答案
相关题目
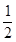 O2(g) = H2O(g) △H=E3 ③
O2(g) = H2O(g) △H=E3 ③