题目内容
4.运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;(l)甲醇是重要的可再生燃料.已知在常温常压下:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
H2O(g)═H2O(l))△H=-44.0kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反
应,能说明该反应已达到平衡状态的是cd.
a.体系的密度不发生变
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d 容器内的气体分子总数不再变化
e.单位时问内转移4mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6molSO3,如图1表示SO3物质的量随时间的变化曲线.
达到平衡时,用SO2 表示的化学反应速率为0.05mol•L-1•min-1; SO3的转化率为66.7%(保留小数点后-位):
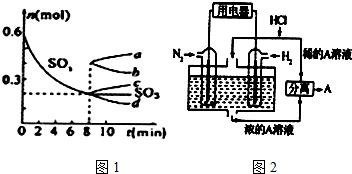
T℃时,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为1.25;T℃时,其他条件不变,在8min时压缩容器体积至0.5L,则n( SO3)的变化曲线为c(填字母).
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示.电池正极的电极反应式是N2+8H++6e-=2NH4+电解质溶液的pH增大(填写增大、减小、不变),A.物质是NH4Cl(写化学式).
分析 (1)根据盖斯定律,将已知反应$\frac{①-②+③×4}{2}$得到CH3OH(l)+O2(g)=CO(g)+2H2O(l)的热化学方程式;
(2)①反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此判断;
②在容积为1L密闭容器中充入0.6molSO3,由图1平衡时SO3物质的量为0.2mol,
2SO2 +O2 ?2SO3,
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
转化率=$\frac{消耗量}{起始量}$×100%;根据K=$\frac{c(S{O}_{3})^{2}}{c(S{O}_{2})^{2}c({O}_{2})}$计算;其他条件不变,在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大;
(3)电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵.
解答 解:(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
将$\frac{①-②+③×4}{2}$得到CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]÷2=442.8kJ•mol-1,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(2)①a.气体质量不变,体系的密度不发生变化,不能说明反应达到平衡状态,故a错误;
b.气体质量不变,S元素质量不变,体系中硫元素的质量百分含量不再变化,不能说明反应达到平衡状态,故b错误;
c.SO2与SO3的体积比保持不变,可说明反应达到平衡状态,故c正确;
d 容器内的气体分子总数不再变化,说明各物质的浓度不变,说明反应达到平衡状态,故d正确;
e.任何状态下,单位时间内转移4mol 电子,同时消耗2mol SO3,不能说明反应达到平衡状态,故e错误.
故答案为:cd;
②在容积为1L密闭容器中充入0.6molSO3,由图1平衡时SO3物质的量为0.2mol,
2SO2+O2 ?2SO3,
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
SO2 表示的化学反应速率为$\frac{\frac{0.4mol}{1L}}{8min}$=0.05mol•L-1•min-1,
SO3的转化率为=$\frac{0.4}{0.6}$×100%≈66.7%;
K=$\frac{c(S{O}_{3})^{2}}{c(S{O}_{2})^{2}c({O}_{2})}$=$\frac{0.{2}^{2}}{0.{4}^{2}×0.2}$=1.25;
其他条件不变,在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大,即为图象c,
故答案为:0.05mol•L-1•min-1;66.7%;1.25; c;
(3)该电池的本质反应是合成氨反应,电池中氢气失电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-=2NH4+,消耗氢离子,所以电解质溶液的PH增大,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液,
故答案为:N2+8H++6e-=2NH4+;增大;NH4Cl.
点评 本题考查较为综合,为高考常见题型,侧重于化学平衡的有关知识、电化学的有关知识的考查,注意外界条件对化学平衡的影响以及有关化学计算,试题较灵活,综合性强,难度较大.

 阅读快车系列答案
阅读快车系列答案| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A. | 四种溶液中,Na2CO3溶液中水的电离程度最大 | |
| B. | 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度 | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3 |
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电流由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.