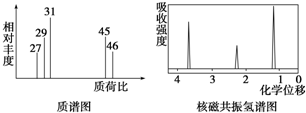
题目内容
19.铜有很多重要的化合物.特别是Cu2+核外电子的特殊构型,其能与很多含有氧或氮元素的配体[如NH3、乙二胺(H2N-CH2-CH2-NH2)、乙酰丙酮(CH3COCH2COCH3)等]形成配合物.
(1)C、N、O元素的电负性由小到大的顺序是C<N<O.
(2)[Cu(NH3)4]2+呈深蓝色,该粒子中配位体的空间构型为三角锥形.
(3)酞菁铜也是Cu2+的一种配合物,被广泛用于墨水生产,其结构如图1.请用箭头标出其中的配位键
 ,该分子中氮原子的杂化方式为sp2和sp3.
,该分子中氮原子的杂化方式为sp2和sp3.(4)CuCl2在湿空气无效中潮解无效,易溶于水、乙醇和丙酮,熔点约100℃.推测氯化铜的晶体类型为分子晶体.
(5)Cu的晶胞如图2所示,铜原子的配位数为12.
分析 (1)元素非金属性越强,得电子能力越强,其电负性的数值越大;
(2)该离子中中心离子是铜离子,配体是氨气分子,用价层电子对互斥理论判断氨气的空间构型为三角锥形;
(3)配位键由提供孤电子对的原子指向提供空轨道的原子;由图中可知N原子只与C原子相连时,N的杂化方式为sp2,与铜原子形成配位键时的杂化方式是sp3;
(4)分子晶体的熔点低,一般易溶于水或有机溶剂;
(5)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积,以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共有,利用均摊法计算Cu原子配位数.
解答 解:(1)元素非金属性越强,得电子能力越强,其电负性的数值越大,所以C<N<O,
故答案为:C<N<O;
(2)该离子中中心离子是铜离子,配体是氨气分子,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形,
故答案为:三角锥形;
(3)配位键由提供孤电子对的N原子指向提供空轨道的Cu2+,所以该配合物中的配位键为: ;由图中可知N原子只与C原子相连时,N的杂化方式为sp2,与铜原子形成配位键时的杂化方式是sp3,
;由图中可知N原子只与C原子相连时,N的杂化方式为sp2,与铜原子形成配位键时的杂化方式是sp3,
故答案为: ;sp2 和sp3;
;sp2 和sp3;
(4)分子晶体的熔点低,一般易溶于水或有机溶剂,则氯化铜的晶体类型为分子晶体,
故答案为:分子晶体;
(5)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积,
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为$\frac{3×8}{2}$=12,
故答案为:12.
点评 本题考查了物质结构和性质,涉及电负性、空间构型、配位键、晶体的类型等,注意孤电子对个数的计算方法,配位数的计算需要学生具有一定的空间想象力,为易错点.

| A. | 两者的质量数不同 | B. | 两者的中子数不同 | ||
| C. | 两者的核外电子数相同 | D. | 两者互为同素异形体 |
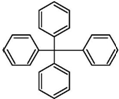 甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子不可能共平面 | |
| C. | 该物质光照下可和氯气发生反应 | |
| D. | 该物质在Fe粉催化下可和液溴发生反应 |
| A. | 阿司匹林 | B. | 青霉素 | C. | 抗酸药 | D. | 麻黄碱 |
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH${\;}_{4}^{+}$、Ca2+ |
| 阴离子 | OH-、NO${\;}_{3}^{-}$、I-、HCO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、HSO${\;}_{4}^{-}$ |
①B的化学式为Ba(OH)2.
②A、B溶液混合加热反应的离子方程式H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ8H++2NO3-+6I-=2NO↑+3I2+4H2O;Ⅱ8H++2NO3-+6I-=2NO↑+3I2+4H2O和4H++NO3-+3Fe2+=NO↑+3Fe3++2H2O.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).

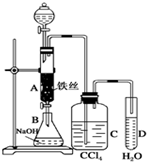 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.