题目内容
15.下列排序正确的是( )| A. | 酸性:H 2CO 3<C 6H 5OH<H 3COOH | B. | 碱性:Ba(OH) 2<Ca(OH) 2<KOH | ||
| C. | 熔点:MgBr 2<SiCl 4<BN | D. | 沸点:PH 3<NH 3<H 2O |
分析 A.碳酸的酸性大于苯酚;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.晶体熔沸点:原子晶体>离子晶体>分子晶体;
D.分子晶体熔沸点与其相对分子质量成正比,含有氢键的氢化物熔沸点较高.
解答 解:A.碳酸的酸性大于苯酚,这三种物质的酸性顺序为:C6H5OH<H2CO3<CH3COOH,故A错误;
B.金属的金属性越强,其最高价氧化物的水化物碱性越强,金属性Ba>Ca>Mg,所以碱性正确的顺序为:Ca(OH)2<Ba(OH)2,故B错误;
C.晶体熔沸点:原子晶体>离子晶体>分子晶体,SiCl4为分子晶体,MgBr2为离子晶体,离子晶体的熔点高于分子晶体,所以SiCl4的熔点小于MgBr2,故C错误;
D.分子晶体熔沸点与其相对分子质量成正比,含有氢键的氢化物熔沸点较高,H2O、NH3分子间存在氢键,沸点高,而H2O的沸点为100℃,NH3在常温时为气体,所以H2O的沸点高于NH3,膦中不含氢键,熔沸点最小,所以沸点:PH3<NH3<H2O,故D正确;
故选D.
点评 本题考查晶体熔沸点比较、元素周期律等知识点,为高频考点,侧重考查学生分析判断能力,知道晶体类型与晶体熔沸点的关系、分子晶体熔沸点影响因素等是解本题关键,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
5.短周期元素X、Y、Z、W的原子序数依次增大,X、W同主族,Y、Z、W三种元素最高正价的代数和为10,且Y、Z、W的最高价氧化物对应的水化物之间均能发生反应.下列说法正确的是( )
| A. | X与W形成的化合物均与BaCl2溶液反应产生沉淀 | |
| B. | Z、W的简单离子均可促进水的电离 | |
| C. | 原子半径:X<Y<Z<W | |
| D. | X与Y形成的化合物中均只含离子键 |
6.在实验中,下列说法不正确的是( )
| A. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| B. | 在Cl2制备实验中,用饱和食盐水除去Cl2中的HCl气体,用NaOH溶液吸收尾气 | |
| C. | 除去CO2气体中混有的少量HCl,可以将气体通入饱和NaHCO3溶液中 | |
| D. | H2在Cl2中燃烧火焰呈淡蓝色 |
10.为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.该元素最稳定的一种原子可以表示为${\;}_{101}^{259}$Md,该原子所含中子的数目为( )
| A. | 56 | B. | 158 | C. | 258 | D. | 101 |
20.有8种物质:①乙烷、②乙烯、③乙炔、④苯、⑤甲苯、⑥溴乙烷、⑦聚乙烯、⑧丁二烯,其中既不能使KMnO4溶液褪色,也不能与溴水发生化学反应的是( )
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
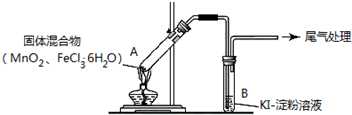
实验操作和现象:
(1)现象 i 中的白雾是盐酸小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象 ii 和a 中的黄色气体,溶液均变红.通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
①方案1 的洗气瓶C中盛放的试剂是饱和NaCl溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象 ii 和a 中的黄色气体,溶液均变红.通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
| 方案1 | 在A、B 间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B 中KI淀粉溶液替换为NaBr 溶液;检验 Fe 2+ | B中溶液呈浅橙红色;未检出Fe 2+ |
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
5.下列化学用语正确的是( )
| A. | CO2的电子式: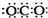 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 甲烷的结构简式:CH4 | D. | 乙烯分子的球棍模型: |
 ;
;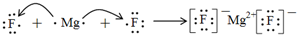 ;
;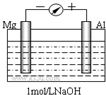 实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验: