题目内容
【题目】100℃时,将![]() 置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:
置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:![]() ,下列结论能说明上述反应在该条件下已经达到平衡状态的有几个( )
,下列结论能说明上述反应在该条件下已经达到平衡状态的有几个( )
①![]() 的消耗速率与
的消耗速率与![]() 的生成速率之比为1:2
的生成速率之比为1:2
②![]() 生成速率与
生成速率与![]() 消耗速率相等
消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤![]() 的物质的量浓度不再改变
的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.3个B.4个C.5个D.6个
【答案】C
【解析】
①无论反应是否达到平衡状态,N2O4的消耗速率与NO2的生成速率之比都为1:2,所以不能证明是否达到平衡状态,故①错误;
②NO2表示的正逆反应速率相等,所以能证明达到平衡状态,故②正确;
③该反应是反应前后气体体积改变的反应,当该反应达到平衡状态时,各物质的物质的量不再改变,所以压强就不再改变,能证明该反应达到平衡状态,故③正确;
④根据质量守恒,无论该反应是否达到平衡状态,混合气体的质量都不改变,所以不能证明该反应是否达到平衡状态,故④错误;
⑤平衡时各种物质的物质的量、浓度等不再发生变化,所以能证明该反应达到平衡状态,故⑤正确;
⑥平衡时各种物质的物质的量、浓度等不再发生变化,烧瓶内气体的颜色不再加深,所以能证明该反应达到平衡状态,故⑥正确;
⑦平衡时各种物质的物质的量、浓度等不再发生变化,质量始终不变,所以当烧瓶内气体的平均相对分子质量不再变化时,能证明该反应达到平衡状态,故⑦正确;
⑧根据质量守恒,反应前后气体质量不变,容器的体积不变,所以烧瓶内气体的密度始终不变,故⑧错误;所以正确的有5个,故C正确。
故选C。

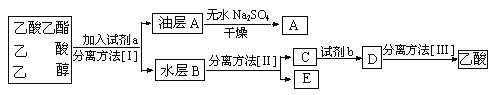
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
【题目】NaCl和NaClO在酸性条件下可发生反应:![]() ,某学习小组拟研究消毒液
,某学习小组拟研究消毒液![]() 主要成分为NaCl和
主要成分为NaCl和![]() 的变质情况.
的变质情况.
(1)此消毒液中NaClO可吸收空气中的![]() 生成
生成![]() 和HClO而变质.写出化学反应方程式:______.
和HClO而变质.写出化学反应方程式:______.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分,从而判断该消毒液是否变质.

限选试剂:![]() 浓硫酸、
浓硫酸、![]() 品红溶液、
品红溶液、![]() 淀粉溶液、
淀粉溶液、![]() 溶液、澄清石灰水、饱和NaCl溶液.
溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案.
所加试剂 | 预期现象和结论 |
向试管A中加足量① ______ ;试管B中加 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;③ ______ ,则消毒液未变质; ④ ______ ,则消毒液完全变质. |
(3)测定消毒液中NaClO的浓度.实验步骤如下:
①量取![]() 消毒液放入锥形瓶中,加入过量的
消毒液放入锥形瓶中,加入过量的![]() 溶液
溶液![]() .
.
②定量分析.使![]() 的酸性
的酸性![]() 溶液和剩余的
溶液和剩余的![]() 发生反应.重复实验3次,测得平均消耗酸性
发生反应.重复实验3次,测得平均消耗酸性![]() 溶液
溶液![]() ;此过程中涉及的反应有:
;此过程中涉及的反应有:![]() ;
;![]()
③计算.消毒液中NaClO的浓度为______![]() 用含a、b、c、V的代数式表示
用含a、b、c、V的代数式表示![]() .
.