题目内容
下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 mol·L-1 氨水中加入少量水,pH减小, 减小
减小
A
【解析】
试题分析:A、水的电离吸热,加热促进电离,H+和OH-浓度增大,Kw增大,PH减小,正确;B、保存FeSO4溶液时,加入稀HNO3酸化会将亚铁离子氧化为铁离子,药品变质,应加入稀硫酸抑制Fe2+水解,错误;C、FeCl3溶液蒸干、灼烧至恒重,蒸干过程中氯化氢挥发,促进水解生成氢氧化铁沉淀,灼烧分解生成氧化铁,错误;D、向0.1 mol?L-1 氨水中加入少量水,促进电离,但溶液体积增大,氢氧根离子和铵离子浓度减小,溶液PH减小,Kb不变, 增大,错误。
增大,错误。
考点:考查弱电解质的电离和盐类的水解。

练习册系列答案
相关题目

 CaS+4CO↑
CaS+4CO↑
 HCl+HClO
HCl+HClO H<0
H<0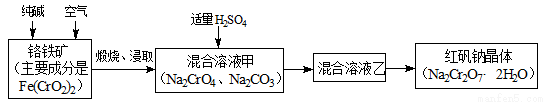
 2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K=________,若继续加水稀释,平衡将_________移动(填“正向”、“逆向”“不”)。

