题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:_______与稀盐酸反应最剧烈;______与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为_____________________________。
Ⅱ.探究同主族元素非金属性的递变规律
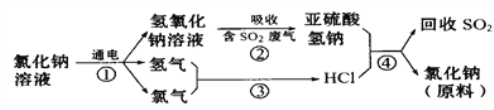
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。

(3)写出装置B中仪器a的名称 ________________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择_____________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为________________________;
【答案】 钠(或Na) 铝( 或Al) SiO32-+2H+=H2SiO3↓ 分液漏斗 A Cl2+ 2Br-===2Cl-+ Br2
【解析】Ⅰ.(1)根据金属性强弱判断反应;根据电子得失守恒比较生成的氢气多少。
(2)稀硫酸与硅酸钠反应生成硅酸沉淀和硫酸钠。
Ⅱ.(3)根据仪器构造书写名称。
(4)根据反应不需要加热且是固体与液体反应判断。
(5)根据氯气能氧化溴化钠书写方程式。
Ⅰ.(1)金属活泼性顺序为:钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钠,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钠失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝;
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,生成硅酸和硫酸钠,反应的离子方程式为SiO32-+2H+=H2SiO3↓;
Ⅱ.(3)由装置图可知a为分液漏斗;
(4)高锰酸钾与浓盐酸反应较为剧烈,无需加热且是固体与液体之间的反应,因此可以选择装置A制取氯气。
(5)反应装置的导气管连接装置D的X导管,因为①处为NaBr溶液,氯气与溴化钠反应生成溴和氯化钠,反应的离子方程式为Cl2+2Br-=2Cl-+Br2。

【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为![]() 、
、![]() 和
和![]() )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
①![]()
②![]()
③![]()
回答下列问题:
化学键 |
|
| (CO)中的 |
|
|
|
|
|
|
|
|
(1)已知反应①中的相关的化学键键能数据如下:由此计算![]() ________
________ ![]() .
. ![]() ,已知
,已知![]() .
. ![]() ,则
,则![]() ________
________ ![]() .
. ![]()
(2)反应①的化学平衡常数![]() 的表达式为________;图
的表达式为________;图![]() 中能正确反映平衡常数
中能正确反映平衡常数![]() 随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
随温度变化关系的曲线为________(填曲线标记字母),其判断理由是_____________________________.
(3)合成气的组成![]() 时体系中的
时体系中的![]() 平衡转化率
平衡转化率![]() 与温度和压强的关系如图
与温度和压强的关系如图![]() 所示.
所示. ![]() 值随温度升高而________(填“增大”或“减小”),其原因是_________________.图
值随温度升高而________(填“增大”或“减小”),其原因是_________________.图![]() 中的压强由大到小为________,其判断理由是____________________________________________
中的压强由大到小为________,其判断理由是____________________________________________