题目内容
7.把mg铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红但质量减小的是( )| A. | NaOH溶液 | B. | CH3COOH | C. | 水 | D. | CH3CH2OH |
分析 A.铜丝灼烧变黑即生成了黑色固体CuO,铜丝质量增加,铜、氧化铜都不与氢氧化钠溶液反应;
B.乙酸与氧化铜反应,导致铜丝的质量减小;
C.氧化铜和铜都不与水反应;
D.CH3CH2OH与氧化铜反应生成铜和乙醛,铜丝质量不变.
解答 解:A.铜丝灼烧变黑即生成了黑色固体氧化铜,铜丝质量增加,当放入NaOH溶液中,不反应,所以铜丝质量增加,故A错误;
B.放入CH3COOH中,氧化铜与乙酸发生反应,铜丝质量减小,故B正确;
C.放入水中,不发生反应,则铜丝质量增加,故C错误;
D.放入CH3CH2OH中,氧化铜被还原为铜,铜丝质量不变,故D错误;
故选B.
点评 本题考查了铜及其化合物性质,题目难度不大,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.一种香豆素的衍生物结构如图所示,关于该有机物说法正确的是( )


| A. | 该有机物的分子式为C9H8O3 | |
| B. | 1mol该有机物与H2发生加成时最多消耗H25mol | |
| C. | 1mol该有机物与NaOH溶液反应时最多消耗NaOH2mol | |
| D. | 1mol该有机物与足量浓溴水反应时最多消耗Br23mol |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含电子数目为10NA | |
| B. | 标准状况下,11.2L己烷所含有的分子数为0.5NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 常温下,4gCH4含有2NA个C-H共价键 |
2.下列说法正确的是( )
| A. | 可逆反应的化学反应速率是指正反应速率 | |
| B. | 在可逆反应里正反应的速率是正值,逆反应的速率是负值 | |
| C. | 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度 | |
| D. | 对于可逆反应来说,反应物转化为生成物没有一定的限度 |
19. 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
变化曲线如图所示.下列说法正确的是( )
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10ml时,$\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
17.下列过程不属于氮的固定的是( )
| A. | 工业合成氨 | B. | 工业上用氨催化氧化法制备硝酸 | ||
| C. | 闪电导致雷雨中含有硝酸 | D. | 豆科植物的根瘤菌制造含氮化合物 |
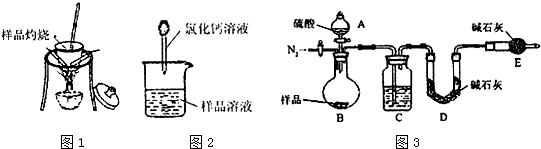
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: