题目内容
漂白粉在空气中容易变质的原因是( )
| A、CaCl2易吸收空气中的水分 |
| B、Ca(ClO)2易与盐酸反应 |
| C、Ca(ClO)2见光易分解 |
| D、Ca(ClO)2易与空气中的CO2和水作用 |
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:漂白粉的有效成分为Ca(ClO)2,由于HClO的酸性比碳酸弱,Ca(ClO)2易与空气中的CO2和H2O反应生成次氯酸,次氯酸不稳定,易分解,以此解答该题.
解答:
解:A.漂白粉在空气中容易失效与CaCl2无关,故A错误;
B.Ca(ClO)2和盐酸发生反应,空气中不含盐酸,不是失效的原因,故B错误;
C.Ca(ClO)2性质稳定,难以分解,故C错误;
D.漂白粉的有效成分为Ca(ClO)2,由于HClO的酸性比碳酸弱,Ca(ClO)2易与空气中的CO2和H2O反应生成次氯酸,次氯酸不稳定,易分解,故D正确.
故选D.
B.Ca(ClO)2和盐酸发生反应,空气中不含盐酸,不是失效的原因,故B错误;
C.Ca(ClO)2性质稳定,难以分解,故C错误;
D.漂白粉的有效成分为Ca(ClO)2,由于HClO的酸性比碳酸弱,Ca(ClO)2易与空气中的CO2和H2O反应生成次氯酸,次氯酸不稳定,易分解,故D正确.
故选D.
点评:本题考查次氯酸钙的性质,为高频考点,侧重于化学与生活的考查,题目难度不大,注意HClO的酸性、不稳定性是决定漂白粉失效的主要原因.

练习册系列答案
相关题目
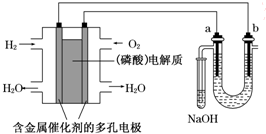 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,正极反应式为:O2+2H2O+4e-═4OH- |
| B、电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、忽略能量损耗,当电池中消耗0.2 g H2时,b极周围会产生2.24L H2 |
环境问题已成为制约社会发展和进步的严重问题.下列做法或说法不正确的是( )
| A、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
| B、将煤气化或液化,获得清洁燃料 |
| C、大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放 |
| D、绿色化学的核心是利用化学原理从头上减少和消除工农业生产等对环境的污染 |
 可逆反应mA(s)+nB(g) pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )
可逆反应mA(s)+nB(g) pC(g)在一定条件下达到平衡后,改变压强,B的体积分数φ(B)与压强的关系如图所示,有关叙述正确的是( )| A、m+n<p |
| B、n>p |
| C、X点时v(正)>v(逆) |
| D、X点比Y点的正反应速率快 |
某一容器中发生如下反应:2NO(g)+O2(g)═2NO2(g);△H=Q kJ?mol-1在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的关系如图所示.下列判断正确的是( )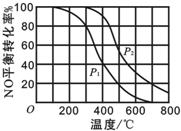

| A、p2>p1且Q<0 |
| B、p2>p1且Q>0 |
| C、p2<p1且Q<0 |
| D、p2<p1且Q>0 |
一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.20 molCl2和0.20 molCO,反应达到平衡前的速率:υ(正)>υ(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和1.2molCO,达到平衡时,Cl2的转化率大于60% |
