题目内容
可以说明反应2HI(g)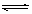 H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③百分组成ω(HI)=ω(I2)
④反应速率υ(H2)=υ(I2)=1/2υ(HI)时
⑤ c(HI):c(H2):c(I2)=2:1:1时
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤ B.①④⑦ C.②⑦⑨ D⑧⑨⑩
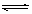 H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( )①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③百分组成ω(HI)=ω(I2)
④反应速率υ(H2)=υ(I2)=1/2υ(HI)时
⑤ c(HI):c(H2):c(I2)=2:1:1时
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤ B.①④⑦ C.②⑦⑨ D⑧⑨⑩
C
判断某可逆是否达到平衡的本质:1、平衡时体系中各组分的浓度保持不变;2、正、逆反应速率相等且不等于0;①错,每时每刻均这样反应;②正确;③错,平衡时不是各组分的百分含量相等而是各组分的百分含量保持不变;④错,每时每刻都是υ(H2)=υ(I2)=1/2υ(HI);⑤错,平衡时各组分的浓度可能相等也可能不相等;⑥错,该反应为等体积反应,无论是否平衡容器内压强均不变;⑦正确;⑧错,反应为等体积反应且状态都是气体,条件一定,混合气体的平均相对分子质量始终不变;⑨正确;⑩错,由于反应为等体积反应,密度为常数;

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
 zC(g)
zC(g) 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
 p C在某温度下达到平衡。
p C在某温度下达到平衡。 2C(g) 已知加入1mol A和2molB,在达到平衡后生成了amolC,此时C在平衡混合物中的体积分数为M%.在相同实验条件下,
2C(g) 已知加入1mol A和2molB,在达到平衡后生成了amolC,此时C在平衡混合物中的体积分数为M%.在相同实验条件下, 2Z(g),X、Y、Z 的起始浓度依次为0.1 mol/L,0.3 mol/L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是
2Z(g),X、Y、Z 的起始浓度依次为0.1 mol/L,0.3 mol/L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是
 2HBr(g),已知加入0.5 mol H2和1 mol Br2时,达到平衡后生成0.5a mol HBr(见表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g),已知加入0.5 mol H2和1 mol Br2时,达到平衡后生成0.5a mol HBr(见表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)~(3)的状态,填写表中的空白。 B(g)2C(g);?△H=QkJ/mol
B(g)2C(g);?△H=QkJ/mol 实验
实验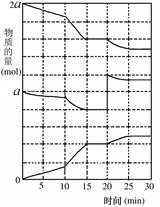
 (g)和3molB(g),此时容器的压强为P(始
(g)和3molB(g),此时容器的压强为P(始 )。
)。 c表示,另一个用b、c表示)
c表示,另一个用b、c表示)