题目内容
已知反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,当有8.7克二氧化锰参 加反应时,则:
(1)盐酸中有 克氯化氢参加反应.
(2)被氧化的氯化氢的物质的量为 .
| ||
(1)盐酸中有
(2)被氧化的氯化氢的物质的量为
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:由方程式可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,n(MnO2)=
=0.1mol,结合反应的方程式计算.
| 8.7g |
| 87g/mol |
解答:
解:n(MnO2)=
=0.1mol,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O 被氧化HCl
1 4 2
0.1mol 0.4mol 0.2mol
(1)参加反应的HCl的物质的量为0.4mol,质量为0.4mol×36.5g/mol=14.6g,
故答案为:14.6;
(2)由以上分析可知,被氧化的氯化氢的物质的量为0.2mol,
故答案为:0.2mol.
| 8.7g |
| 87g/mol |
MnO2+4HCl(浓)
| ||
1 4 2
0.1mol 0.4mol 0.2mol
(1)参加反应的HCl的物质的量为0.4mol,质量为0.4mol×36.5g/mol=14.6g,
故答案为:14.6;
(2)由以上分析可知,被氧化的氯化氢的物质的量为0.2mol,
故答案为:0.2mol.
点评:本题考查氧化还原反应的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握元素的化合价的变化,为解答该题的关键,答题注意注意结合方程式计算,难度不大.

练习册系列答案
相关题目
下列电子式书写不正确的是( )
A、 |
B、 |
C、 |
D、 |
欲回收溶于酒精的苯酚,有如下操作:
①蒸馏
②过滤
③静置分液
④加入足量的金属钠
⑤通入过量CO2
⑥加入足量NaOH溶液
⑦加入足量FeCl3溶液
⑧加入足量浓溴水.
其合理的操作步骤是( )
①蒸馏
②过滤
③静置分液
④加入足量的金属钠
⑤通入过量CO2
⑥加入足量NaOH溶液
⑦加入足量FeCl3溶液
⑧加入足量浓溴水.
其合理的操作步骤是( )
| A、④⑤③ | B、⑥①⑤② |
| C、⑥①⑤③ | D、⑧②⑤③ |
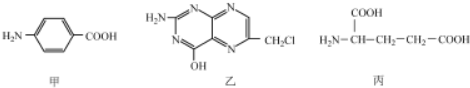

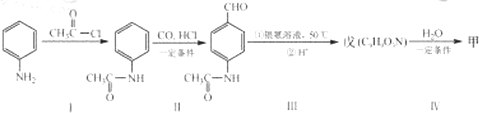

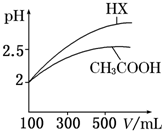 回答下列问题:
回答下列问题: