题目内容
13.用NA表示阿伏加德罗常数,下列说法正确的是( )①18g D2O含有的电子数为10NA
②同温、同压下,相同体积的氟气和氩气所含的原子数相等
③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
④在标准状况下,22.4LSO3的物质的量为1mol
⑤4℃时5.4mL的水所含的原子总数为0.9NA
⑥60gSiO2晶体中含有2NA个Si-O键
⑦1mol Na2O2与水完全反应时转移电子数为2NA
⑧200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA.
| A. | ③⑤⑥⑧ | B. | ①②④⑦ | C. | ③⑤ | D. | ③④⑤⑥ |
分析 ①根据质量、摩尔质量、分子数、电子数、阿伏伽德罗常数之间的关系式计算判断;
②根据同温、同压下,体积、气体摩尔体积、分子数、原子数之间的关系式计算判断;
③根据体积、气体摩尔体积、分子数、原子数之间的关系式计算判断;
④根据气体摩尔体积的适用范围判断;
⑤根据体积、密度、摩尔质量、分子数、原子数、阿伏伽德罗常数之间的关系式计算判断;
⑥二氧化硅中含有4个Si一0键;
⑦根据物质的量与转移电子之间的关系判断;
⑧铝离子易水解.
解答 解:①每个D2O分子中含有10个电子,但18gD2O的物质的量小于1mol,所以18gD2O含有的电子数小于10NA,故错误;
②同温、同压下,相同体积的氟气和氩气的物质的量相等,但氟气是双原子分子,氩气是单原子分子,所以所含的原子数不等,故错误;
③标准状况下,11.2L以任意比例混合的氮气和氧气的物质的量是0.5mol,氮气和氧气都是双原子分子,所以标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA,故正确;
④标准状况下,SO3是固体,气体摩尔体积不适用于该物质,故错误;
⑤4℃时,水的密度是1g/mL,所以5.4mL的水的质量是5.4g,物质的量是0.3mol,所含的原子总数为0.9NA,故正确;
⑥60gSiO2物质的量=$\frac{60g}{60g/mol}$=1mol,结合二氧化硅中含有4个Si一0键分析,60g SiO2晶体中含有4NA个Si一0键,故错误;
⑦2mol过氧化钠与水反应转移电子数为2NA,所以1molNa2O2与水完全反应时转移电子数为NA,故错误;
⑧铝离子易水解,离子总数小于NA,故错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠和冷水反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| D. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OH-+HCO3-═CO32-+H2O |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
| A. | 增大反应物浓度 | B. | 升高温度 | C. | 增大压强 |
| A. | 反应中B2O3是氧化剂 | B. | 若消耗2.24LNH3理论上可得2.5gBN | ||
| C. | 填料的作用可使反应物充分接触 | D. | 反应时NH3需要用无水CaCl2干燥 |
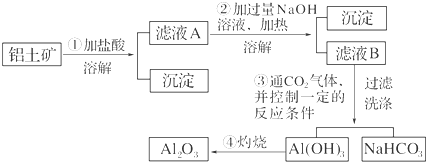
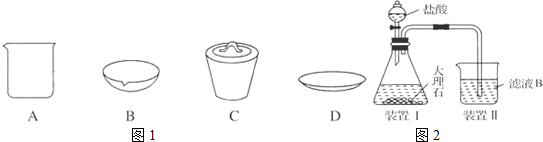
 .
. 2N02 △H<0中N0的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)﹤v(逆)的点是 ( )
2N02 △H<0中N0的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)﹤v(逆)的点是 ( )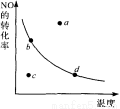
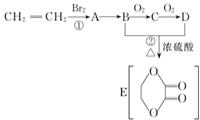 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)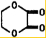 +2H2O.
+2H2O.