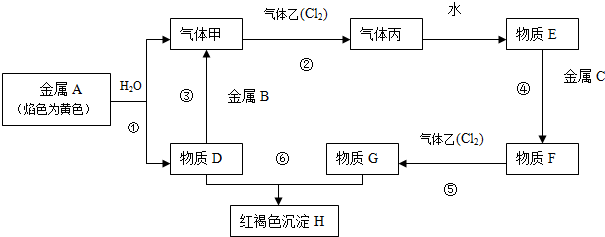
题目内容
13.实验室有NH4HCO3和NaHSO3的混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数.(已知酸性KMnO4被SO2还原的反应原理:SO2+MnO4-+H2O→SO42-+Mn2++H+)回答以下问题:(1)化学小组主要选用了下列药品和仪器进行实验.(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
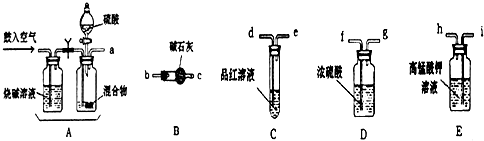
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b…)
a→i→h→d→e→f→g→b→c.
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是排出装置中原有空气;加酸后A装置再次鼓入空气的作用是将生成的气体全部送入后续装置.
(3)E装置的作用是吸收二氧化硫气体,防止二氧化硫对测定结果的影响.
(4)实验中若E瓶中溶液褪色,则测定结果可能会偏高.(填高或低)
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为60.3%.
分析 (1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大;
(5)碱石灰增重4.4g,二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,最后求出NH4HCO3的质量分数.
解答 解:(1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量,所以装置连接顺序是aihdefgbc,
故答案为:i;h;d;e;b;c;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置,
故答案为:排出装置中原有空气;将生成的气体全部送入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体,防止二氧化硫对测定结果的影响,
故答案为:吸收二氧化硫气体,防止二氧化硫对测定结果的影响;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,根据实验原理分析可知二氧化碳气体的质量偏大,则混合物中NH4HCO3偏大,测定结果将偏高,
故答案为:高;
(5)碱石灰增重4.4g,即二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,NH4HCO3的质量分数为$\frac{7.9g}{13.1g}$×100%=60.3%,
故答案为:60.3%.
点评 本题主要元素化合物性质、化学工艺流程、基本操作与方案设计、数据分析与处理等,难度中等,是对所学知识的综合利用,为高考常见题型,对学生综合分析问题的能力有一定的要求.

| A. | 第四周期 | B. | 第二周期 | C. | 第ⅣA主族 | D. | 第ⅤA主族 |
 ,关于该物质的叙述正确的是( )
,关于该物质的叙述正确的是( )| A. | 一定条件下与氢气反应可以生成硬脂酸甘油酯 | |
| B. | 该物质不能使酸性KMnO4溶液褪色 | |
| C. | 与氢氧化钠溶液混合加热能得到肥皂的主要成分 | |
| D. | 与其互为同分异构且完全水解后产物相同的油脂还有三种 |
| A. | 4.8g石墨中的共价键数目 | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数 | |
| C. | 一定条件下,将1mol SO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数 | |
| D. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数 |
| A. | Fe和足量稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| B. | 将Fe(NO3)3溶液与少量HI混合:8H++2NO3-+6I-═4H2O+3I2+2NO↑ | |
| C. | 用过量氨水吸收SO2的反应:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 少量Ca(OH)2和NaHCO3反应 Ca2++OH-+HCO3-═CaCO3↓+H2O |
| A. | 若Q、M为烯烃,则N可以使溴的CCl4溶液褪色 | |
| B. | 若Q、M均为一元羧酸,则N的分子式可能是CH2O2 | |
| C. | 三种物质的组成元素相同,相对分子质量相同 | |
| D. | 三种物质的分子结构相似,分子组成相差若干个“CH2”基团 |
①酸性:HClO4>H2SO4>H3PO4>H2SiO3
②稳定性:HF<H2O<H2S
③碱性:KOH>NaOH>Mg(OH)2
④熔沸点:Rb>K>Na>Li
⑤粒子半径:F-<Na+<Mg2+<Al3+
⑥O与S为同主族元素,且O比S的非金属性强
⑦第二周期元素从Li到F,非金属性逐渐增强
⑧在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂,砹(At)为无色固体,AgAt难溶于水也不溶于稀硝酸.
| A. | ①③⑥⑦ | B. | ②④⑤⑧ | C. | ①③⑤⑧ | D. | ④⑤⑥⑦ |
| A. | 得0.20mol NaCl和0.08mol NaHCO3 | |
| B. | 剩0.04mol Na2CO3,得0.20mol NaCl | |
| C. | 剩0.06mol HCl,得0.14mol NaCl和0.14mol NaHCO3 | |
| D. | 得0.06mol NaCl和0.08mol NaHCO3 |