题目内容
6.24mLNO和NO2混合气体的试管倒置于水中,待液面上升到位置不再改变时,试管内气体总体积缩小一半.(1)原混合气体中NO和NO2的体积比为1:3
(2)若在剩余气体中通入3mLO2,则又有4mL水进入试管?
(3)若在原24mL混合气体中通入9mLO2,并倒置于水中,溶液将充满整个试管.
分析 (1)发生反应:3NO2+H2O=2HNO3+NO,根据差量法计算NO2的体积,进而计算原混合气体中NO的体积;
(2)剩余的气体为NO,通入氧气发生反应:4NO+3O2+2H2O=4HNO3,据此计算参加反应NO的体积,进入试管的水的体积等于参加反应NO的体积;
(3)发生反应:4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3,根据方程式计算需要氧气的体积.
解答 解:(1)设原混合气体中NO2的体积为V,则:
3NO2+H2O=2HNO3+NO 体积减小
3 2
V 12mL
所以V=$\frac{12mL×3}{2}$=18mL
故NO的体积为24mL-18mL=6mL,
则原混合气体中NO和NO2的体积比为6mL:18mL=1:3,
故答案为:1:3;
(2)剩余的气体为NO,通入氧气发生反应:4NO+3O2+2H2O=4HNO3,由方程式可知通入3mL氧气时有4mLNO发生反应,故进入试管中的水的体积为4mL,故答案为:4;
(3)混合气体中NO的体积为6mL、NO2的体积比为18mL,由4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3,可知需要氧气的体积为:6mL×$\frac{3}{4}$+18mL×$\frac{1}{4}$=9mL,故答案为:9.
点评 本题考查化学方程式有关计算,注意利用差量法与总反应方程式进行解答,侧重于学生的分析能力和计算能力的考查,难度中等.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
1.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50g46%的乙醇水溶液中,含H原子总数目为3NA | |
| C. | 7.8gNa2O2加入足量的水中,反应转移的电子总数目为0.2NA | |
| D. | 常温,21.0g乙烯和环丙烯的混合气体中含有的碳原子数为1.5NA |
15.下列说法正确的是( )
①需要加热方能发生的反应一定是吸收能量的反应
②释放能量的反应在常温下一定很容易发生
③反应是释放能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小
④释放能量的反应加热到一定温度引发后,停止加热反应也能继续进行.
①需要加热方能发生的反应一定是吸收能量的反应
②释放能量的反应在常温下一定很容易发生
③反应是释放能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小
④释放能量的反应加热到一定温度引发后,停止加热反应也能继续进行.
| A. | 只有③④ | B. | 只有①② | C. | ①②③④ | D. | 只有②③④ |
16.下列表示电子式的形成过程正确的是( )
| A. | H+ → → | B. | Na×+ →Na →Na | ||
| C. | Mg${\;}_{×}^{×}$+2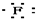 →Mg2+ →Mg2+ | D. |  +${\;}_{×}^{×}$C${\;}_{×}^{×}$ +${\;}_{×}^{×}$C${\;}_{×}^{×}$ → → |
 实验室用下列反应制取CO2和CO:H2C2O4$\stackrel{浓硫酸}{→}$CO2+CO+H2O,然后用如图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液.试回答下列各题:
实验室用下列反应制取CO2和CO:H2C2O4$\stackrel{浓硫酸}{→}$CO2+CO+H2O,然后用如图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液.试回答下列各题: 工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动: