题目内容
10.${\;}_{16}^{34}$S微粒中的质子数是16,中子数是18,核外电子数是16.它与Na形成的化合物的电子式 ,此化合物类型离子化合物(填“离子化合物”或“共价化合物”).
,此化合物类型离子化合物(填“离子化合物”或“共价化合物”).
分析 质量数=质子数+中子数;原子:质子数=核外电子数;硫化钠为离子化合物,2个钠离子与硫离子通过离子键结合在一起;含有离子键的化合物为离子化合物,据此解答.
解答 解:${\;}_{16}^{34}$S微粒中质子数为16,质量数为34,所以核外电子数为16,中子数为:34-16=18,硫化钠为离子化合物,2个钠离子与硫离子通过离子键结合在一起,硫化钠电子式为: ,硫化钠含有离子键为离子化合物;
,硫化钠含有离子键为离子化合物;
故答案为:16;18;16; ;离子化合物.
;离子化合物.
点评 本题考查了化学用语的使用,明确质量数、质子数、中子数、电子数之间关系,熟悉阴阳离子电子式表示形式是解题关键,题目难度不大.

练习册系列答案
相关题目
19.下列有机物的命名错误的是( )
| A. |  2-乙基-1-丁烯 2-乙基-1-丁烯 | |
| B. |  3-乙基-3-己醇 3-乙基-3-己醇 | |
| C. | (CH3)3CCH(C2H5)CH3 2,2-二甲基-3-乙基丁烷 | |
| D. |  1,3-二溴丙烷 1,3-二溴丙烷 |
15.高温下在恒容密闭容器中 mg 丁烷完全裂化生成甲烷、乙烷、乙烯、丙烯四种气体,甲烷的体积分数为 20%,则下列说法中不正确的是( )
| A. | 将反应后所得混合气体充分燃烧,其耗氧量与反应前mg丁烷充分完全燃烧的耗氧量 相同 | |
| B. | 将反应后所得混合气体充分燃烧,将所有产物通过足量 Na2O2 固体,固体增重的质量 大于mg | |
| C. | 反应后容器中气体的平均摩尔质量为29 | |
| D. | 反应后乙烯和丙烯物质的量之比为 3:2 |
2.下列变化属于物理变化的是( )
| A. | 煤的气化 | B. | 煤的干馏 | C. | 石油的分馏 | D. | 乙烯聚合 |
18.“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1mol•L-1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×10-9]( )
| A. | 若将溶液不断加水稀释,则水的电离程度增大 | |
| B. | 溶液中各离子浓度大小关系:c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| C. | 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=10-5 | |
| D. | 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8 mol•L-1时即能产生沉淀 |


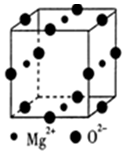 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.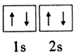 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).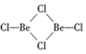 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.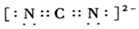 .
.
