题目内容
在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)?C(g)+D(g)当下列物理量不再变化时,表明反应已达平衡的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、混合气体的平均相对分子质量 |
| D、气体总物质的量 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、随着反应的进行体系压强不变,容器内压强保持不变,不一定达平衡状态,故A错误;
B、混合气体的密度不变,说明气体的质量不变,即正逆反应速率相等,故B正确;
C、反应体系中气体的物质的量是一定值,如果混合气体的平均相对分子质量,说明气体总质量不变,达化学平衡状态,故C正确;
D、反应体系中气体的物质的量是一定值,不一定平衡,故D错误;
故选BC.
B、混合气体的密度不变,说明气体的质量不变,即正逆反应速率相等,故B正确;
C、反应体系中气体的物质的量是一定值,如果混合气体的平均相对分子质量,说明气体总质量不变,达化学平衡状态,故C正确;
D、反应体系中气体的物质的量是一定值,不一定平衡,故D错误;
故选BC.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化合物属于弱电解质的是( )
| A、HCl |
| B、Ba(OH)2 |
| C、CO2 |
| D、HF |
用NA表示阿佛加德罗常数,下列叙述正确的是( )
| A、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| B、通常情况5.6升氢气含0.5NA个原子 |
| C、1L1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
下列物质的水溶液能导电而本身不是电解质的是( )
| A、氨气 | B、硫酸 |
| C、氧化钠 | D、硫酸钠 |
以下反应均与几种常见的金属元素有关,其离子方程式不正确的是( )
| A、FeCl3溶液与H2S溶液反应:2Fe3++H2S=2Fe2++S↓+2H+ |
| B、AlCl3溶液与NaAlO2溶液反应:Al3++3AlO2-+6H2O=4 Al(OH)3↓ |
| C、Fe(OH)2与HNO3溶液反应:Fe(OH)2+2H+=Fe2++2H2O |
| D、Zn与CuSO4溶液反应:Zn+Cu2+=Zn2++Cu |
下列说法正确的是( )


| A、浓HNO3具有强氧化性,能将C、Si、P分别氧化成CO2、SiO2、H3PO4 |
| B、Cl2、SO2都可用于漂白,按1:1混合通入品红溶液漂白效果更佳 |
| C、浓H2SO4与Cu反应只表现其强氧化性 |
| D、NH3极易溶于水,但可用如图吸收氨 |
对于反应M+N=P,如果温度每升高10℃,化学反应速率增加到3倍,在20℃时完成该反应的30%需要81min,若将温度升高到40℃,完成该反应的30%需要时间为( )
| A、9min |
| B、27min |
| C、13.5min |
| D、3min |
在水或水溶液中,不能通过化合反应制得下列物质中的( )
| A、Na2CO3 |
| B、FeCl2 |
| C、FeCl3 |
| D、NaHCO3 |
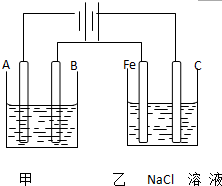 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: