题目内容
8.一定条件下,某密闭容器中充入等物质的量的A、B两种气体,发生反应:A(g)+B(g)═2C(g).达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )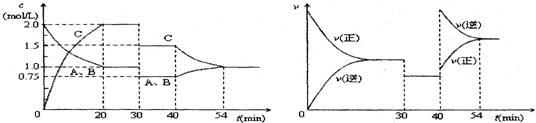
| A. | 30min时减小容积 | |
| B. | 40min时加入催化剂 | |
| C. | 0~20min内A的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 正反应为吸热反应 |
分析 从该题图1可知,0-20min是反应:A(g)+B(g)?2C(g)达到平衡的过程,20min时各浓度保持不变,正逆反应速率相等,反应达到平衡状态,20-30min,是保持平衡状态过程;反应物和生成物的浓度都减少,结合右图象知,30min改变条件,正逆反应速率相等且减小平衡不移动;40-54min,左图知,反应物浓度增大生成物浓度减小,右图知正逆反应速率都增大,且与原平衡点无接触点,逆反应速率大于正反应速率,当正逆反应速率相等时,再次达到平衡状态,据此分析回答计算选项.
解答 解:A、从右图可知,30min时正反应速率和逆反应速率同时降低.30min时减小容积,压强减小,平衡不动,物质浓度减小,但此时左图中30-40min,A、B的浓度在减少,C的浓度在增加.故A错误;
B、催化剂值改变反应速率不改变化学平衡,40min由图象可知,反应物浓度增大生成物浓度减小,右图知正逆反应速率都增大,且与原平衡点无接触点,逆反应速率大于正反应速率,当正逆反应速率相等时,再次达到平衡状态,故B错误;
C.0-20min内,由左图可知,A的变化浓度为1mol/L,平均反应速率=$\frac{1mol/L}{20min}$=0.05mol•L-1•min-1,故C正确;
D、当反应A(g)+B(g)?2C(g),反应前后气体总的量不变.压强改变,平衡不移动.右图中30-40min,平衡不移动,此时左图中30-40min,A、B的浓度在减少,C的浓度在增加.显示平衡向正反应方向移动与压强改变平衡不移动矛盾;正反应为吸热反应,在其它条件不变时,升高反应温度,有利于吸热反应,平衡向吸热反应方向移动,即平衡向正反应方向移动,升高反应温度,反应速率加快与右图中30-40min正反应速率和逆反应速率同时降低矛盾.故D错误.
故选:C.
点评 该题为化学平衡图象题.解化学平衡图象题,看图象:一看轴,弄清横坐标和纵坐标的意义.二看点,弄清图象上点的意义,看起点,交点,转折点,终点.三看量的变化,利用相关公式进行计算,明确外界条件对化学平衡的影响是解本题的关键,题目难度中等.

| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
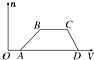 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题. 制取
制取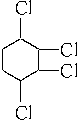 ,其合成流程如下:
,其合成流程如下: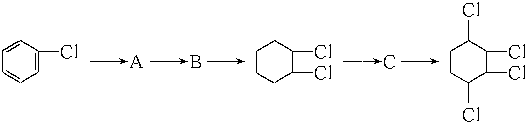
 这两步反应的化学方程式.
这两步反应的化学方程式.