题目内容
某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了如图所示的甲、乙、丙三套装置(图中的支撑仪器均未画出,“Δ”表示酒精灯热源),每套装置又可划分为①、②、③三部分.仪器中盛放的试剂为:a![]() 无水乙醇(沸点:78℃);b
无水乙醇(沸点:78℃);b![]() 铜丝,c
铜丝,c![]() 无水硫酸铜:d
无水硫酸铜:d![]() 新制氢氧化铜悬浊液.
新制氢氧化铜悬浊液.

(1)简述三套方案各自的优点:甲:________;乙:________;丙:________.
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流从左至右的顺序表示为:________(例如甲①,乙②,丙③).
(3)若要保证此实验有较高的效率,还需补充的仪器有________,理由是________.
(4)实验中能验证乙醇氧化产物的实验现象是________.
(5)装置中,若撤去第①部分,其他操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:________.
解析:
|
(1)甲.②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜、长导管起到冷凝回流乙醇蒸气的作用.;乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应避免干扰生成物的验证.;丙:①中氧气发生装置中无水生成,且装置简单. (2)丙①;甲②;乙③. (3)温度计,控制水浴温度在78℃或略高于78℃,使乙醇蒸气平稳流出,减少挥发.提高反应效率. (4)C处无水硫酸铜变蓝;d处生成红色沉淀. (5)C2H5OH |

请回答下列问题:?
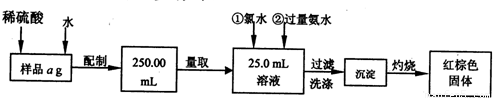
(1)铁屑表面少量的铁锈(主要成分为Fe2O3·aH2O)对制取硫酸亚铁有无影响 (填“有”或“无”)。其原因是: 。如有影响将如何操作? (若无影响,此问可以不答)。
(2)FeSO4在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于废铁屑含有C、Si等杂质,为了使FeSO4溶液的浓度增大,便于反应后分离溶液和残渣,该小组实验时采取了水浴加热和趁热过滤的方法。这样做的主要目的是为了防止 。你认为实验时的水浴温度最好控制在 ℃?左右。??
(3)测定晶体中结晶水含量所用的实验仪器除托盘天平(或物理天平)、研钵、坩埚、坩埚钳、三脚架、泥三角、酒精灯、药匙外,还有 ;判断晶体中结晶水完全失去的实验操作是 。?
(4)计算硫酸亚铁晶体化学式中x的实验值表达式为x= ?。(已知:硫酸亚铁晶体中结晶水的质量为m g、硫酸亚铁晶体的质量为w g)?
(5)由于铁屑或铁丝与硫酸反应速率慢,实验过程中有的同学提出采用电解的方法,可以加快制取FeSO4溶液的反应速率,该方法的电解质溶液是 ,阳极的电极反应方程式为: 。?
请你再写出一种(不包括改变温度和硫酸的浓度)以铁单质为反应物,能加快制取FeSO4溶液反应速率的方法: 。?
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。

| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度
③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。


 [AgI2]-
[AgI2]-

 [AgI2]-
[AgI2]-