题目内容
(10分)如图所示:已知甲池的总反应式为:2CH3OH+3O2+4KOH
2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称。甲池是 装置,乙池是 装置。
(2)B(石墨)电极的名称是 。 在图中标明电子移动的方向。
(3)通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
【答案】
(14分)(1)原电池(化学能转变成电能) 电解池(电能转变成化学能)(2) 阳极
(3)O2+2H2O+4e-=4OH-
(4)4AgNO3+2H2O 4Ag+4HNO3+O2↑ (5)280
4Ag+4HNO3+O2↑ (5)280
【解析】(1)根据装置可知,甲是原电池,乙是电解池。
(2)原电池中负极失去电子,正极得到电子。所以甲中通入甲醇的是负极,通入氧气的是正极。则B是阳极。电子从原电池的负极经导线传递到电解池的阴极,从电解池的阳极经导线传递到原电池的正极。
(3)氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。
(4)乙中阴极氢离子放电生成氢气,阳极是银离子放电生成银,所以总反应式为
4AgNO3+2H2O 4Ag+4HNO3+O2↑。
4Ag+4HNO3+O2↑。
(5)铁电极形成的是银,物质的量是5.40g÷108g.mol=0.05mol,转移电子是0.05mol,所以根据电子得失守恒可知,消耗氧气是0.05mol÷4=0.0125mol,标准状况下的体积是0.0125mol×22.4L/mol=0.280L=280ml。

练习册系列答案
相关题目
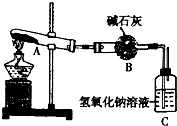 (2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.
(2013?郑州一模)一定温度下,硫酸铜受热分瞬生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧比钠溶液吸收.利用如图所示装置加热硫酸铜粉末直至完全分解.若硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如表所示.

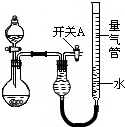 (2010?漳州二模)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
(2010?漳州二模)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)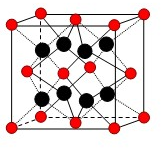 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表: 17.
17.