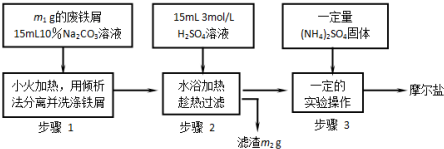
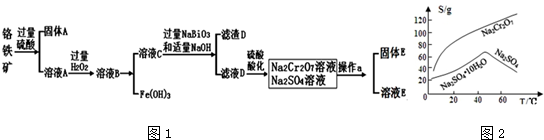
题目内容
4.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,一电极反应为:O2+2H2O+4e-═4OH-,下列叙述不正确的是( )| A. | O2通入正极区 | |
| B. | 总反应为:2H2+O2═2H2O | |
| C. | 正极发生氧化反应 | |
| D. | 负极区电极反应为 2H2+4OH--4e-═4H2O |
分析 根据燃料电池的工作原理和规律:氢氧燃料电池是将化学能转变为电能的装置,工作时,通入燃料氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答 解:A、在燃料电池中,通入氧气的一极为电池的正极,故A正确;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致即2H2+O2═2H2O,故B正确;
C、通入氧气的一极为电池的正极,发生还原反应,故C错误;
D、通入燃料氢气的一极为电池的负极,发生氧化反应,因为KOH溶液作电解液,所以电极反应为2H2+4OH--4e-═4H2O,故D正确.
故选C.
点评 本题考查学生燃料电池的工作原理以及电极反应方程式的书写知识,属于基本知识的考查,难度不大,关键在于区分正极反应和负极,以及正负极发生的反应.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目


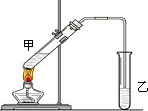 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: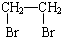 .
.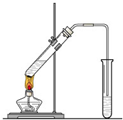 在实验室我们也可以用右图所示的装置制取乙酸乙酯.
在实验室我们也可以用右图所示的装置制取乙酸乙酯.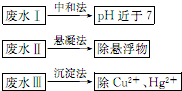 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.