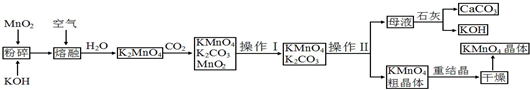
题目内容
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:B、 ,C、 ,D、 ,E、 ;
(2)写出A、B、C形成的化合物M的化学式 ;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为 ;
(4)D单质与M的水溶液反应的离子方程式: .
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:B、
(2)写出A、B、C形成的化合物M的化学式
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为
(4)D单质与M的水溶液反应的离子方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,A是其单质是密度最小的物质,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;B为氧元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为铝元素;E与C同周期,其原子半径在该周期最小,则E为氯元素.
解答:
解:依据分析可知:A为氢,B为氧,C为钠,D为铝,E为氯,
(1)B为氧,C为钠,D为铝,E为氯,故答案为:氧;钠;铝;氯;
(2)H、O、Na组成的化合物M为NaOH,
故答案为:NaOH;
(3)AlCl3在熔融状态下不导电,则AlCl3 属于共价化合物,含有共价键,故答案为:共价键;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(1)B为氧,C为钠,D为铝,E为氯,故答案为:氧;钠;铝;氯;
(2)H、O、Na组成的化合物M为NaOH,
故答案为:NaOH;
(3)AlCl3在熔融状态下不导电,则AlCl3 属于共价化合物,含有共价键,故答案为:共价键;
(4)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题以元素推断为载体,考查元素化合物性质、原子结构位置与周期律关系、化学用语等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
A、向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-
| ||||
| B、用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | ||||
| C、次氯酸钠溶液中通入过量二氧化硫:ClO-+H2O+SO2=HClO+HSO3- | ||||
D、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
|
A、B、C、D、E五种短周期元素原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数的和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍,A、E同一主族.下列说法正确的是( )
| A、原子半径大小顺序为:E>D>C>B>A |
| B、A、B、C、D四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C、D、E四种元素与A 元素形成的最简单化合物的沸点依次升高 |
| D、D与A、E均可形成具有强氧化性的化合物,可用于城市自来水的杀菌消毒 |