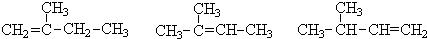题目内容
13. 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
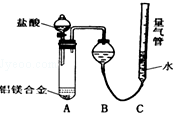
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.实验方案一:铝镁合金$\stackrel{盐酸}{→}$测定生成气体的体积
实验装置:问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是:不需要(填“需要”或“不需要”).
(2)为准确测定生成气体的体积,实验中应注意的问题是(只要求写出其中一点):检查装置的气密性或合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等)
实验方案二:铝镁合金$\stackrel{氢氧化钠溶液}{→}$过滤,测定剩余固体质量
问题讨论:
(1)称取一定质量的铝镁合金粉末样品,加入过量的NaOH溶液,充分反应.实验中发生反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)过滤、洗涤、干燥、称量剩余固体.若未洗涤固体,测得镁的质量分数将偏高(填“偏高”或“偏低”).
实验方案三:铝镁合金$\stackrel{氢氧化钠溶液}{→}$过滤后的滤液 $\stackrel{盐酸}{→}$过滤,测定沉淀质量
问题讨论:
(1)甲同学认为该方案不可行,试说明理由:Al(OH)3是两性氢氧化物,加入足量盐酸无沉淀生成(加入盐酸的量不易控制).
(2)乙同学认为只要调整所加试剂的顺序,就可以达到实验目的,如果他的看法正确,则所得的沉淀是Mg(OH)2.
(3)丙同学认为也可以通过用足量A物质代替盐酸来达到实验目的,则A物质可以是CO2,请写出对应反应的化学方程式:NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3.
分析 探究一:(1)氯化氢极易溶于水,又是排水法测定氢气体积,所以挥发的氯化氢和混有的水蒸气不影响氢气体积的测定结果;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
探究二:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
探究三:(1)镁铝合金溶于氢氧化钠溶液,过滤得到生成偏铝酸钠溶液,加入盐酸的量不易控制,测定结果不准确;
(2)先加盐酸溶解生成氯化铝、氯化镁溶液,加入过量氢氧化钠溶液得到氢氧化镁沉淀;
(3)上述流程中生成的滤液为偏铝酸钠溶液,最好通入过量二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠.
解答 解:探究一:(1)由于氯化氢极易溶于水,又是排水法测定氢气体积,所以挥发的氯化氢和混有的水蒸气不影响氢气体积的测定结果,所以不需要装有碱石灰的干燥装置,故答案为:不需要;
(2)反应中装置的气密性、合金是否完全溶解都会影响测定结果,所以需要检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等)
故答案为:检查装置的气密性或合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等);
探究二:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
[探究三](1)镁铝合金溶于氢氧化钠溶液,过滤得到生成偏铝酸钠溶液,加入盐酸的量不易控制,Al(OH)3是两性氢氧化物,加入足量盐酸无沉淀生成(加入盐酸的量不易控制),测定结果不准确;
故答案为:Al(OH)3是两性氢氧化物,加入足量盐酸无沉淀生成(加入盐酸的量不易控制);
(2)先加盐酸溶解生成氯化铝、氯化镁溶液,加入过量的氢氧化钠溶液得到氢氧化镁沉淀;
故答案为:Mg(OH)2;
(3)上述流程中生成的滤液为偏铝酸钠溶液,用足量A物质代替盐酸来达到实验目,最好通入过量二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠:NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3;
故答案为:NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3.
点评 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O | |
| C. | 向NaHCO3溶液中滴加盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
| A. | C5H10O2的酯有9种结构 | B. | 异丁烷的一氯代物有2种 | ||
| C. | 淀粉和纤维素互为同分异构体 | D. | C9H12含苯环的烃有8种 |
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ba(HCO3)2与澄清石灰水反应 | ||
| C. | Ca(HCO3)2与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢.
| A. | ②⑥ | B. | ③④⑤⑥ | C. | ③④⑥ | D. | ①② |
| A. | 0.5mol | B. | 1mol | C. | 1.5mol | D. | 2mol |
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌
D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
E.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处.
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |