题目内容
2.下列说法正确的是( )| A. | 金属氧化物不可能是酸性氧化物 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 某物质溶于水所得溶液能导电,该物质一定是电解质 | |
| D. | 醋酸溶液中存在两种共价化合物分子 |
分析 A.能和碱反应生成盐和水的氧化物是酸性氧化物,金属氧化物可能是酸性氧化物;
B.完全电离的电解质是强电解质,部分电离的电解质是弱电解质,电解质强弱与化合物类型无关,共价化合物可能是强电解质;
C.电解质是指在水溶液或熔化状态下能导电的化合物,导电是自身电离出自由移动的离子;
D.醋酸中存在弱电解质的电离平衡,存在醋酸分子和水分子.
解答 解:A.金属氧化物Mn2O7是酸性氧化物,故A错误;
B.完全电离的电解质是强电解质,部分电离的电解质是弱电解质,电解质强弱与化合物类型无关,共价化合物可能是强电解质,如硫酸、硝酸等都是强电解质,故B错误;
C.二氧化碳溶于水所得溶液能够导电,但属于非电解质,二氧化碳本身不能电离出离子,溶液导电是二氧化碳和水反应生成碳酸电离,CO2为非电解质,故C错误;
D.醋酸中存在弱电解质的电离平衡,醋酸和水都是弱电解质,所以醋酸溶液中存在醋酸分子和水分子,均为共价化合物,故D正确;
故选D.
点评 本题考查金属氧化物与酸性氧化物、强弱电解质与化合物类型关系、弱电解质的电离等知识,侧重考查基本概念,电解质强弱与电离程度有关,与化合物类型无关,为易错题,题目难度不大.

练习册系列答案
相关题目
12.下列反应方程式书写正确的是( )
| A. | 甲醛和足量银氨溶液充分反应:HCHO+2Ag(NH3)2++2O- $\stackrel{加热}{→}$ HCOO-+NH4++2Ag↓+H2O+3NH3 | |
| B. | 往苯酚钠溶液中通入少量二氧化碳气体: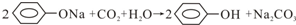 | |
| C. | 向盛有硫酸铜水溶液的试管里加入过量氨水:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O | |
| D. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
17.关于下列有机物性质的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
7.分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有(不考虑立体异构)( )
| A. | 16 种 | B. | 13 种 | C. | 10 | D. | 8 |
11.10℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为HCO3-+H2O?H2CO3+OH-.
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3,该分解反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确.原因是加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,Ba2++CO32-=BaCO3↓.
能不能选用Ba(OH)2溶液?不能(答“能”或“不能”)
②将加热后的溶液冷却到10℃,若溶液的pH等于(填“大于”、“小于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| PH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3,该分解反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确.原因是加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,Ba2++CO32-=BaCO3↓.
能不能选用Ba(OH)2溶液?不能(答“能”或“不能”)
②将加热后的溶液冷却到10℃,若溶液的pH等于(填“大于”、“小于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
 请回答下列问题.
请回答下列问题. .
.
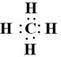 ,其空间构型为正四面体.
,其空间构型为正四面体.