题目内容
下列离子方程式中,正确的是( )
| A、碳酸钡与甲酸反应:BaCO3+2 H+=Ba2++CO2↑+H2O |
| B、足量NaOH溶液与NH4HS溶液反应:OH-+NH4+=NH3?H2O |
| C、用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ |
| D、硫酸型酸雨放置一段时间溶液的pH下降:2H2SO3+O2=4H++2SO42- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.弱电解质写化学式;
B.二者反应生成硫化钠、一水合氨和水;
C.硫酸钙属于微溶物;
D.亚硫酸不稳定,易被氧化生成硫酸
B.二者反应生成硫化钠、一水合氨和水;
C.硫酸钙属于微溶物;
D.亚硫酸不稳定,易被氧化生成硫酸
解答:
解:A.弱电解质写化学式,甲酸是弱电解质,要写化学式,离子方程式为BaCO3+2HCOOH=Ba2++CO2↑+H2O+2HCOO-,故A错误;
B.二者反应生成硫化钠、一水合氨和水,离子方程式为2OH-+NH4++HS-=NH3.H2O+S2-+H2O,故B错误;
C.硫酸钙属于微溶物,水垢中的硫酸钙为沉淀,应该写化学式,所以离子方程式为CaSO4+CO32-=CaCO3+SO42-,故C错误;
D.亚硫酸不稳定,易被氧化生成硫酸,离子方程式为2H2SO3+O2=4H++2SO42-,故D正确;
故选D
B.二者反应生成硫化钠、一水合氨和水,离子方程式为2OH-+NH4++HS-=NH3.H2O+S2-+H2O,故B错误;
C.硫酸钙属于微溶物,水垢中的硫酸钙为沉淀,应该写化学式,所以离子方程式为CaSO4+CO32-=CaCO3+SO42-,故C错误;
D.亚硫酸不稳定,易被氧化生成硫酸,离子方程式为2H2SO3+O2=4H++2SO42-,故D正确;
故选D
点评:本题考查了离子方程式正误判断,涉及氧化还原反应、难溶物的转化等知识点,同时考查学生灵活运用知识解答问题的能力,明确物质之间的反应、离子方程式书写规则即可解答,注意微溶物的处理方法,如果是澄清石灰水应该写离子,石灰乳写化学式,易错选项是C.

练习册系列答案
相关题目
有关化学用语正确的是( )
A、-CH3(甲基)的电子式为  |
B、硝基苯的结构简式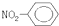 |
| C、乙烯的结构简式CH2CH2 |
| D、苯的分子式C6H6 |
下列化学应用中不涉及氧化还原反应的是( )
| A、工业上由硅的氧化物制备硅单质 |
| B、生活中使用明矾净水,除去水中的悬浮的微小颗粒 |
| C、漂白粉用作疫区的环境消毒 |
| D、过氧化钠用作呼吸面具的供氧剂 |
 某有机物是药物生产的中间体,其结构简式为下列有关叙述正确的是( )
某有机物是药物生产的中间体,其结构简式为下列有关叙述正确的是( )| A、该有机物与Br2水发生加成反应 |
| B、该有机物与浓硫酸混合加热可发生消去反应 |
| C、该有机物经催化氧化后能发生银镜反应 |
| D、1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH |
下列条件下能大量共存的离子组是( )
| A、在含有大量Fe3+的溶液中:K+、Na+、Cl-、SCN- |
| B、使酚酞试液变红的溶液:Ca2+、K+、HCO3-、NO3-、NO3- |
| C、某强酸性溶液中:K+、Na+、I-、MnO4- |
| D、在c(H+)=1.0×10-13mol?L-1的溶液中:Na+、NO3-、[Al(OH)4]-、SO32- |
CS2(液体)能在氧气中燃烧生成CO2和SO2,将0.228g CS2 在448mL(标况)O2中燃烧,将燃烧后的混合气体恢复到标况时体积为( )
| A、ll2mL |
| B、448mL |
| C、224mL |
| D、336mL |
 丁香油酚的结构简式如图所示,它不具有的化学性质是( )
丁香油酚的结构简式如图所示,它不具有的化学性质是( )| A、燃烧 |
| B、使酸性高锰酸钾溶液褪色 |
| C、与溴加成 |
| D、与NaHCO3溶液反应放出二氧化碳 |
下列判断错误的是( )
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:SiO2>NaCl>SiI4 |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、热稳定性:HF>H2O>NH3 |