题目内容
【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中6种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 单质是稳定的半导体材料,用于制造芯片 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色(透过蓝色钴玻璃片) |
Z | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
M | 原子结构示意图为 |
(1)Q元素所在周期表的位置为_____。
(2)W单质的电子式为_____。
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为_____。
(4)Y的金属性强于X,请结合原子结构解释其原因_____。
(5)下列对于M及其化合物的推断中,正确的是_____(填序号)。
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是_____(写出一条即可)。
【答案】第三周期,第ⅣA  2Al+2OH-+2H2O=2AlO2-+3H2↑ 钠和钾位于同一主族,同主族元素从上到下半径逐渐增大,原子核对核外电子的吸引能力减弱,失电子能力逐渐增强,金属性增强 ①② 制加碘食盐
2Al+2OH-+2H2O=2AlO2-+3H2↑ 钠和钾位于同一主族,同主族元素从上到下半径逐渐增大,原子核对核外电子的吸引能力减弱,失电子能力逐渐增强,金属性增强 ①② 制加碘食盐
【解析】
Q单质是稳定的半导体材料,用于制造芯片,则Q为Si元素;Q、W、X都位于第三周期,W的最高正化合价为+7价,则W为Cl;X的最高价氧化物对应的水化物在本周期中碱性最强,X为Na;Y焰色试验(透过蓝色钴玻璃)火焰呈紫色,则Y为K;Z是地壳中含量最高的金属元素,其合金可用于制造飞机外壳,为Al,M的原子结构示意图为 ,是Br,Q、W、X、Y、Z、M分别是Si、Cl、Na、K、Al、Br,以此来解答。
,是Br,Q、W、X、Y、Z、M分别是Si、Cl、Na、K、Al、Br,以此来解答。
(1)Q元素是Si元素,有三个电子层,最外层电子数为4,所在周期表的位置为是第三周期第ⅣA;
(2)氯气分子中氯原子形成一对共用电子对,W单质的电子式 ;
;
(3)Z是铝,它的单质与X的最高价氧化物对应的水化物(氢氧化钠)反应为铝和氢氧化钠溶液的反应,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑:离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)Y(K)的金属性强于X(Na),钠和钾位于同一主族,同主族元素从上到下半径逐渐增大,原子核对核外电子的吸引能力减弱,失电子能力逐渐增强,金属性增强,金属性钾大于钠;
(5)①M(Br)的最低负化合价为-1价,W(Cl)的最低负化合价为-1价,故①正确;
②溴的非金属性弱于氯,M(Br)的氢化物的稳定性弱于W(Cl)的氢化物的稳定性,故②正确;
③溴的非金属性弱于氯,单质的氧化性溴弱于氯气,溴不能与氯化钠的水溶液发生置换反应,故③错误;
正确的是①②;
(6)与M(Br)位于同一主族,电子层数比M多一层的元素是碘,在生活中的用途是制加碘食盐。

【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
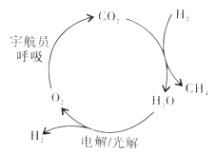
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
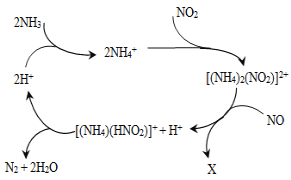
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。
②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
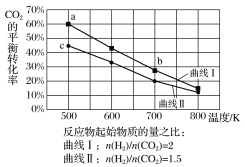
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
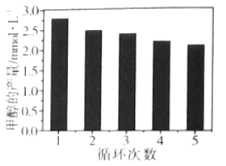
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)