题目内容
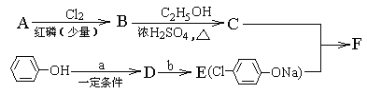
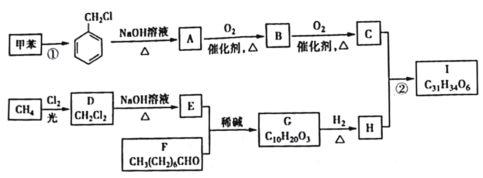
【题目】有机物I是一种治疗高血脂病的新药,其合成路线如下:
已知:a. 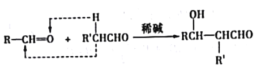 b.
b. 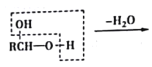 RCHO
RCHO
回答下列问题。
(1)①的反应类型是______________;A的名称是______________。
(2)C中官能团的名称为______________;②的反应条件为______________。
(3)H的结构简式为______________。
(4)写出D→E的化学方程式:______________。
(5)化合物W的相对分子质量比C的大28 ,写出满足下列条件的所有W的结构简式:______________。
①属于芳香族化合物②遇FeCl3溶液能发生显色反应,能发生银镜反应③其核磁共振氢谱有4种不同化学环境的氢,峰面积之比为6:2:1:1
(6)结合题目信息,设计用甲苯和丙醛为原料制备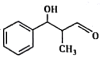 的合成路线_______________。(其他无机原料自选,合成路线用A
的合成路线_______________。(其他无机原料自选,合成路线用A![]() B…
B…![]() 目标产物来表示)
目标产物来表示)
【答案】取代反应(或卤代反应) 苯甲醇 羧基 浓硫酸、加热 CH3(CH2)5C(CH2OH)3 CH2Cl2+2NaOH→HCHO+2NaCl+H2O【或CH2Cl2+2NaOH→CH2(OH)2+2NaCl、CH2(OH)2→HCHO+H2O】 

【解析】
甲烷和氯气在光照条件下发生取代反应生成D(CH2Cl2),D在氢氧化钠的水溶液、加热条件下发生取代反应,但同一个碳原子上的两个羟基不稳定会失水生成醛,则E为HCHO,CH3(CH2)6CHO和甲醛反应生成G,根据已知信息,G为 ,G和氢气发生加成反应生成H,H为
,G和氢气发生加成反应生成H,H为 。甲苯在光照条件下与氯气发生取代反应生成
。甲苯在光照条件下与氯气发生取代反应生成 ,
, 水解得到A,A为
水解得到A,A为 ,A氧化生成B,B为
,A氧化生成B,B为 ,B进一步氧化生成C,C为
,B进一步氧化生成C,C为 ,C与H发生酯化反应生成I,I为
,C与H发生酯化反应生成I,I为 ,据此分析。
,据此分析。
(1)反应①为甲苯和Cl2发生的反应,生成 ,故反应类型为取代反应;
,故反应类型为取代反应; 经碱性条件水解生成A,A为
经碱性条件水解生成A,A为 (苯甲醇);
(苯甲醇);
(2)C是由B催化氧化得来的,B是由A催化氧化得来的,A为苯甲醇,B为苯甲醛,C为苯甲酸,故C的官能团为羧基;反应②为H和C得来的,经分析H是醇,C是酸,故二者之间反应是酯化反应,反应条件为浓硫酸、加热;
(3)根据上述分析,H的结构简式为 ;
;
(4)D→E的化学方程式为:CH2Cl2+2NaOH→HCHO+2NaCl+H2O;
(5)根据已知条件可以,W的相对分子质量比C大28说明W的分子式为C9H10O2,属于芳香族化合物则结构中含有苯环、遇FeCl3显色说明结构中存在酚羟基、能发生银镜反应说明有醛基结构,再根据核磁共振氢谱可以得出W的结构简式可能是 ;
;
(6)根据题目信息,可将甲苯与氯气发生取代反应生成氯甲苯,氯甲苯经碱溶液加热生成苯甲醛,在根据已知条件将苯甲醛与丙醛发生反应生成目标化合物,合成路线是: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中6种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 单质是稳定的半导体材料,用于制造芯片 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色(透过蓝色钴玻璃片) |
Z | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
M | 原子结构示意图为 |
(1)Q元素所在周期表的位置为_____。
(2)W单质的电子式为_____。
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为_____。
(4)Y的金属性强于X,请结合原子结构解释其原因_____。
(5)下列对于M及其化合物的推断中,正确的是_____(填序号)。
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是_____(写出一条即可)。
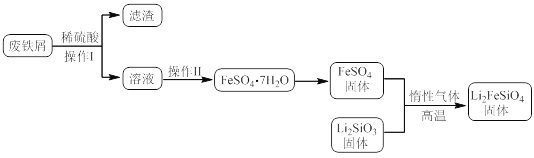
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二)Li2FeSiO4含量测定:
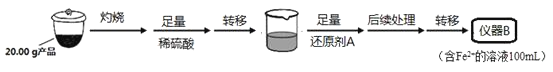
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B__,仪器C__。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是__。
(3)操作Ⅱ的步骤__,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需__。
(4)还原剂A可用SO2,写出该反应的离子方程式__,此时后续处理的主要目的是__。
(5)滴定终点时现象为__;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为_。