题目内容
11.下列叙述正确的是( )| A. | 1 mol的CH4质量为16g/mol | |
| B. | 3.01×1023个CO2分子的质量约为22g | |
| C. | H2O的摩尔质量为18g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
分析 A.质量的单位为g,g/mol为摩尔质量的单位;
B.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算二氧化碳的质量;’
C.摩尔质量的单位为g/mol;
D.没有指出物质状态,不能使用标况下的气体摩尔体积计算.
解答 解:A.1 mol的CH4质量为:16g/mol×1mol=16g,故A错误;
B.3.01×1023个CO2分子的物质的量为0.5mol,其质量约为:44g/mol×0.5mol=22g,故B正确;
C.H2O的摩尔质量为18g/mol,故C错误;
D.标况下1mol气体的体积约为22.4L,若不是气体,其体积不一定为22.4L,故D错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确质量与摩尔质量的区别为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.针对近一时期来我省部分地区发生的多起燃气事故和我市的几起燃气泄漏险情,市公用事业与房产局、市煤气总公司等多个部门和单位联合推出了安全使用燃气宣传周活动(5月28日-6月3日),倡导市民“关爱生命,安全使用燃气”.假如你在家中发现燃气(煤气或液化气等)泄漏,你首先应该做的是( )
| A. | 立即关闭煤气阀门 | B. | 立即打开排风扇 | ||
| C. | 立即在家打电话通知煤气管理所 | D. | 用明火查找漏气部位 |
18.分子式为C4H8O的三元环同分异构体共有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
15.下列有关判断正确的是( )
| A. | 0.1mol/LNa2CO3溶液:c(Na+)=2c(H2CO3)+2 c(HCO3-)+c(CO32?) | |
| B. | 能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 | |
| C. | 任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 将0.2 mol•L-1的HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)=c(Na+) |
16.下列说法中,正确的是(设阿伏加德罗常数的数值为6.02×1023)( )
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
20.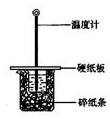 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会无影响
(5)他们记录的实验数据如下:
已知反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.
①计算完成表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol.
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会无影响
(5)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
①计算完成表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol.
1.配制500mL 1mol•L-1的NaCl溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.