题目内容
若溶液中由水电离产生的c(OH-)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Na+、Cl-、CO32- |
| D、K+、I-、NO3-、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:常温时,若水溶液中由水电离产生的c(OH-)为1×10-13mol/L,为酸或碱溶液,根据离子之间不能结合生成水、气体、沉淀等,则离子大量共存,以此来解答.
解答:
解:常温时,若水溶液中由水电离产生的c(OH-)为1×10-13mol/L,为酸或碱溶液,
A.碱性条件下Al3+不能大量共存,故A错误;
B.无论溶液呈酸性还是碱性,离子之间都不发生任何反应,可大量共存,故B正确;
C.酸性条件下CO32-不能大量共存,故C错误;
D.酸性条件下I-与NO3-、发生氧化还原反应而不能大量共存,故D错误.
故选B.
A.碱性条件下Al3+不能大量共存,故A错误;
B.无论溶液呈酸性还是碱性,离子之间都不发生任何反应,可大量共存,故B正确;
C.酸性条件下CO32-不能大量共存,故C错误;
D.酸性条件下I-与NO3-、发生氧化还原反应而不能大量共存,故D错误.
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应的考查,注意水的电离的影响因素,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列叙述中正确的是( )
| A、1mol任何纯净物都含有相同的分子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol氢中含有2mol氢原子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
下列说法正确的是( )
| A、能与酸反应生成盐和水的氧化物一定是碱性氧化物 |
| B、把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用 |
| C、将Ba(OH)2溶液滴到明矾溶液中,当SO42-恰好沉淀完全时,铝只以AlO2-形式存在 |
| D、在含有Cu(NO3)2、Mg(NO3)2、Fe(NO3)3溶液中加入过量锌粉,最先被还原的是Cu2+ |
下列实验操作中需要用玻璃棒的是( )
①过滤 ②蒸发 ③溶解 ④蒸馏 ⑤萃取.
①过滤 ②蒸发 ③溶解 ④蒸馏 ⑤萃取.
| A、①②③ | B、②③④ |
| C、③④⑤ | D、①④⑤ |
下列说法正确的是( )
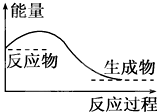

| A、任何化学反应都伴随着能量的变化 |
| B、H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 |
| C、化学反应中能量的变化都表现为热量的变化 |
| D、对于如图所示的过程,是吸收能量的过程 |
下列实验操作或装置错误的是( )
A、 蒸馏 |
B、 过滤 |
C、 萃取 |
D、 转移溶液 |
下列有关反应限度的叙述正确的是( )
| A、大多数化学反应在一定条件下都有一定的限度 |
| B、依据焓判据:NH4HCO3受热分解可自发进行 |
| C、使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| D、FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 |
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.