题目内容
【题目】亚氯酸钠![]() 是重要漂白剂.探究小组开展如下实验,回答下列问题:
是重要漂白剂.探究小组开展如下实验,回答下列问题:
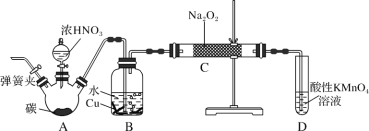
实验Ⅰ:制取![]() 晶体按如图装置进行制取。
晶体按如图装置进行制取。

已知:![]() 饱和溶液在低于
饱和溶液在低于![]() 时析出
时析出![]() ,高于
,高于![]() 时析出
时析出![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
(1)用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______
溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______![]() 填仪器名称
填仪器名称![]() ;
;
(2)装置C的作用是______;
(3)装置B内生成的![]() 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成![]() ,生成
,生成![]() 的反应方程式为______.
的反应方程式为______.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______;
(5)反应后,经以下步骤可从装置D的溶液获得![]() 晶体.请补充完整操作iii.
晶体.请补充完整操作iii.
![]() 蒸发结晶;
蒸发结晶;![]() 趁热过滤;iii.______;
趁热过滤;iii.______;![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的![]() 晶体中含少量
晶体中含少量![]() 。产生
。产生![]() 最可能的原因是______;
最可能的原因是______;
![]() 中有
中有![]() 气体产生,并有部分进入D装置内
气体产生,并有部分进入D装置内
![]() 中浓硫酸挥发进入D中与NaOH中和
中浓硫酸挥发进入D中与NaOH中和
![]() 中的硫酸钠进入到D装置内
中的硫酸钠进入到D装置内
(7)测定样品中![]() 的纯度。测定时进行如下实验:
的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:![]() ,将所得混合液稀释成100mL待测溶液。
,将所得混合液稀释成100mL待测溶液。
取![]() 待测溶液,加入淀粉溶液做指示剂,用c
待测溶液,加入淀粉溶液做指示剂,用c![]()
![]() 标准液滴定至终点,测得消耗标准溶液体积的平均值为V
标准液滴定至终点,测得消耗标准溶液体积的平均值为V![]() 已知:
已知:![]()
![]() 确认滴定终点的现象是______;
确认滴定终点的现象是______;
![]() 所称取的样品中
所称取的样品中![]() 的物质的量为______
的物质的量为______![]() 用含c、V的代数式表示
用含c、V的代数式表示![]() 。
。
【答案】量筒 防止D瓶溶液倒吸到B瓶中![]() 或安全瓶
或安全瓶![]()
![]()
![]() 和NaCl 用
和NaCl 用![]() 左右的热水洗涤3遍
左右的热水洗涤3遍![]() 热水温度高于
热水温度高于![]() ,低于
,低于![]() a 滴加最后一滴
a 滴加最后一滴![]() 标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点
标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点 ![]()
【解析】
装置B中制备得到![]() ,所以B中反应为
,所以B中反应为![]() 和
和![]() 在浓
在浓![]() 的作用生成
的作用生成![]() 和
和![]() ,装置C为安全瓶,装置D反应后的溶液获得
,装置C为安全瓶,装置D反应后的溶液获得![]() 晶体,装置D中生成
晶体,装置D中生成![]() ,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体,
,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体,
![]() 用
用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液是计算、量取、溶解、转移、洗涤、定容、摇匀等步骤选择仪器;
溶液是计算、量取、溶解、转移、洗涤、定容、摇匀等步骤选择仪器;
![]() 装置C的作用是安全瓶,有防倒吸作用,装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
装置C的作用是安全瓶,有防倒吸作用,装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
![]() 装置B中制备得到
装置B中制备得到![]() ,所以B中反应为
,所以B中反应为![]() 和
和![]() 在浓
在浓![]() 的作用生成
的作用生成![]() 和
和![]() ,二氧化氯和氢氧化钠反应生成
,二氧化氯和氢氧化钠反应生成![]() ;
;
![]() 由题目信息可知,应控制温度
由题目信息可知,应控制温度![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl;
和NaCl;
![]() 从装置D的溶液获得
从装置D的溶液获得![]() 晶体,需要蒸发结晶、趁热过滤、洗涤、干燥;
晶体,需要蒸发结晶、趁热过滤、洗涤、干燥;
![]() 中可能发生
中可能发生![]() 浓
浓![]() ,产生的
,产生的![]() 被带入D中,
被带入D中,![]() 与
与![]() 反应生成硫酸钠;
反应生成硫酸钠;
![]() 碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴
碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴![]() 标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
![]() 根据化学反应可得关系式:
根据化学反应可得关系式:![]() ,根据关系式计算。
,根据关系式计算。
![]() 用
用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管,所以还需要量筒,
溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管,所以还需要量筒,
故答案为:量筒;
![]() 装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案为:防止D瓶溶液倒吸到B瓶中![]() 或安全瓶
或安全瓶![]() ;
;
![]() 装置B中制备得到
装置B中制备得到![]() ,所以B中反应为
,所以B中反应为![]() 和
和![]() 在浓
在浓![]() 的作用生成
的作用生成![]() 和
和![]() ,反应的方程式为
,反应的方程式为![]() ,二氧化氯和双氧水、氢氧化钠反应生成
,二氧化氯和双氧水、氢氧化钠反应生成![]() ,反应方程式为
,反应方程式为![]() ,
,
故答案为:![]() ;
;
![]() 由题目信息可知,应控制温度
由题目信息可知,应控制温度![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是
和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是![]() 和NaCl,
和NaCl,
故答案为:![]() 和NaCl;
和NaCl;
![]() 从装置D的溶液获得
从装置D的溶液获得![]() 晶体,需要蒸发结晶、趁热过滤、洗涤、干燥操作,所以第iii步操作是用
晶体,需要蒸发结晶、趁热过滤、洗涤、干燥操作,所以第iii步操作是用![]() 左右的热水洗涤3遍
左右的热水洗涤3遍![]() 热水温度高于
热水温度高于![]() ,低于
,低于![]() ,故答案为:用
,故答案为:用![]() 左右的热水洗涤3遍
左右的热水洗涤3遍![]() 热水温度高于
热水温度高于![]() ,低于
,低于![]() ;
;
![]() 中可能发生
中可能发生![]() 浓
浓![]() ,产生的
,产生的![]() 被带入D中,
被带入D中,![]() 与
与![]() 反应生成硫酸钠,浓硫酸难挥发,硫酸钠是难挥发的盐,不会进入D,故a正确,b、c错误,故选:a,
反应生成硫酸钠,浓硫酸难挥发,硫酸钠是难挥发的盐,不会进入D,故a正确,b、c错误,故选:a,
故答案为:a;
![]() 碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴
碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴![]() 标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点,
标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点,
故答案为:滴加最后一滴![]() 标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
![]() 根据
根据![]() , 在25mL溶液中,n(NaClO2)=
, 在25mL溶液中,n(NaClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×
× ![]() =
=![]() ×
×![]() 。所以所取样品中n(NaClO2)=
。所以所取样品中n(NaClO2)=![]() ×
×![]() ×
×![]() =
=![]() 。
。
故答案为:![]() 。
。

 智慧小复习系列答案
智慧小复习系列答案