题目内容
有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤H2O、⑥Na2O2.
(1)上述物质中,属于共价化合物的是
(2)②号物质的电子式为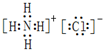
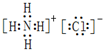 、用电子式表示⑤号物质的形成过程:
、用电子式表示⑤号物质的形成过程:
 .
.
(1)上述物质中,属于共价化合物的是
⑤
⑤
(填序号,下同),既存在离子键又存在非极性键的是⑥
⑥
(2)②号物质的电子式为
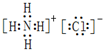
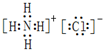


分析:(1)含共价键的化合物为共价化合物,含离子键的一定为离子化合物,离子化合物中可存在非极性共价键;
(2)氯化铵为离子化合物,水为共价化合物.
(2)氯化铵为离子化合物,水为共价化合物.
解答:解:(1)因一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键.所以②、③、⑤含有极性键,②、③中含有离子键和极性键,④中含有非极性键,⑥中含有离子键和非极性键,①中无化学键,含有离子键的化合物就是离子化合物,全部由共价键形成的化合物是共价化合物,所以⑤是共价化合物,既存在离子键又存在非极性键的是⑥,
故答案为:⑤;⑥;
(2)NH4Cl是离子化合物,由铵根离子和氯离子构成,其电子式为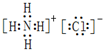 ;
;
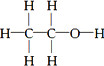
H2O是由2个H原子和1个O原子通过形成共用电子对形成的,形成过程为: ,
,
故答案为: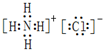 ;
; .
.
故答案为:⑤;⑥;
(2)NH4Cl是离子化合物,由铵根离子和氯离子构成,其电子式为
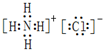 ;
;H2O是由2个H原子和1个O原子通过形成共用电子对形成的,形成过程为:
 ,
,故答案为:
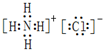 ;
; .
.点评:本题考查化学键,为高考高频考点,把握化学键与化合物的关系为解答的关键,注意电子式的书写及化合物形成过程,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
经测定,乙醇的分子式是C2H6O。由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一。
① ②
②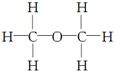
为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用下图给定装置进行实验确定乙醇的结构。
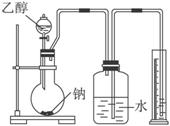
(1)学生甲得到一组实验数据,见下表:
乙醇的物质的量/mol | 氢气的体积/L |
0.10 | 1.12(标准状况) |
根据以上数据推断乙醇的结构应为______________(用①②表示),理由为______________。
(2)同学乙分别准确称量
(3)同学丙认为实验成功的关键有下列几点,其中正确的是_______________。(填序号)
①装置气密性要良好 ②实验开始前准确确定乙醇的量 ③钠足量 ④广口瓶内水必须充满 ⑤氢气体积的测算方法正确、数据准确
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需知道的数据是____________。
(5)实验结束后,四名同学从乙醇的可能结构分析入手,对乙醇和钠的量的关系进行了讨论。如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是_______________。