题目内容
将50 mL 0.5 mol·L-1的Al2(SO4)3溶液加入4.0 mol·L-1的NaOH溶液可得到
A.45 mL B.30 mL C.15 mL D.60 mL
解析:本题考查铝盐与强碱溶液作用生成Al(OH)3的计算。
(1)反应关系:
Al3++3OH-![]() Al(OH)3↓生成白色沉淀
Al(OH)3↓生成白色沉淀
Al(OH)3+OH-![]()
![]() +2H2O沉淀溶解
+2H2O沉淀溶解
Al3++4OH-![]()
![]() +2H2O沉淀恰好完全溶解
+2H2O沉淀恰好完全溶解
(2)根据上述反应关系,可进行Al(OH)3沉淀量的快速计算
①当n(OH-)∶n(Al3+)<3∶1时,Al3+未完全沉淀,Al(OH)3的沉淀量只由nOH-决定,即:
n〔Al(OH)3〕=![]() n(OH-) [3OH-—Al(OH)3]
n(OH-) [3OH-—Al(OH)3]
②当n(OH-)∶n(Al3+)=3∶1时,两者恰好反应生成Al(OH)3沉淀,则n〔Al(OH)3〕=![]() n(OH-)=n(Al3+) [Al3+—3OH-—Al(OH)3]
n(OH-)=n(Al3+) [Al3+—3OH-—Al(OH)3]
③当n(OH-)∶n(Al3+)>3∶1但小于4∶1,沉淀会部分溶解,Al(OH)3的沉淀量等于最大量减去溶解量,由Al(OH)3+OH-![]()
![]() +2H2O知溶解量等于过量的OH-的物质的量即n(总OH-)-3n(Al3+),所以Al(OH)3的沉淀量n〔Al(OH)3〕=n(Al3+)-[n(总OH-)-3n(Al3+)]=4n(Al3+)-n(总OH-)。
+2H2O知溶解量等于过量的OH-的物质的量即n(总OH-)-3n(Al3+),所以Al(OH)3的沉淀量n〔Al(OH)3〕=n(Al3+)-[n(总OH-)-3n(Al3+)]=4n(Al3+)-n(总OH-)。
④当n(OH-)∶n(Al3+)≥4∶1,强碱过量到将生成的Al(OH)3全部溶解,此时n〔Al(OH)3〕=0。
因产生的Al(OH)3可以溶解在过量的NaOH溶液中,所以产生
Al3+—3OH-—Al(OH)3↓
V1=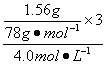 =
=
V2=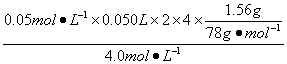 =45 mL
=45 mL
答案:AC

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
