题目内容
6.工业上制备纯硅反应的化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若通过缩小体积增大压强,则活化分子百分数变大,反应速率加快 | |
| B. | 若Si-Cl、H-H、Si-Si、H-Cl的键能分别为Ea、Eb、Ec、Ed(单位:),则△H=(4Ea+2Eb-Ec-4Ed )KJ/mol | |
| C. | 该反应能量变化如图所示,则Ea1、Ea2分别代表该反应正向和逆向的活化能,使用催化剂Ea1、Ea2都减小,△H也变小 | |
| D. | 由如图和题目信息可知该反应△H>0,△S>0,所以在较高温度下可自发进行 |
分析 A.通过缩小体积增大压强,导致反应物的浓度增大,但活化分子百分数不变;
B.△H=反应物的键能总和-生成物的键能总和;
C.使用催化剂Ea1、Ea2都减小,△H不变;
D.根据△G=△H-T•△S<0反应自发进行分析.
解答 解:A.通过缩小体积增大压强,导致反应物的浓度增大,单位时间单位体积内活化分子有效碰撞次数增加,化学反应速率加快,但活化分子百分数不变,故A错误;
B.每个Si与4个Si相连,形成4根Si-Si键,每根Si-Si键同时属于相连的2个Si,那么1molSi有2molSi-Si键,△H=反应物的键能总和-生成物的键能总和=(4Ea+2Eb-2Ec-4Ed)KJ/mol,故B错误;
C.使用催化剂Ea1、Ea2都减小,但△H不变,故C错误;
D.该反应,反应物的总能量小于生成物的总能量,为吸热反应,△H>0,反应后混乱度增加,△S>0,高温时△H-T•△S<0反应自发,故D正确;
故选D.
点评 本题考查反应热的计算、化学反应速率和反应自发性的判断,综合性较强,难度中等,易错点为B选项,1molSi有2molSi-Si键.

练习册系列答案
相关题目
16.下列金属中,常温下能用于盛装浓硝酸的是( )
| A. | Al | B. | Cu | C. | Fe | D. | Mg |
17.塑料、合成橡胶和合成纤维这三大合成材料主要是以石油、煤和天然气为原料生产的.下列有关说法错误的是( )
| A. | 通过煤的干馏、煤的液化和气化,可获得洁净的燃料 | |
| B. | 天然气作为化工原料主要用于合成氨和生产甲醇 | |
| C. | 乙烯、丙烯、甲烷等化工基本原料主要是由石油分馏得到 | |
| D. | 聚乙烯塑料的主要成分聚乙烯是由乙烯通过聚合反应制得 |
14.下列物质不属于合金的是( )
| A. | 紫铜 | B. | 生铁 | C. | 硬铝 | D. | 不锈钢 |
1.在一定温度下,反应A22(g)+B2(g)?2AB(g)达到反应限度的标志是( )
| A. | 正、逆反应速率相等且都等于零 | |
| B. | c(A2):c(B2):c(AB)=1:1:2 | |
| C. | A2、B2和AB的物质的量不再改变 | |
| D. | 单位时间内消耗n mol A2的同时生成2n mol AB |
11.实验是化学研究的基础.下列对实验现象的描述错误的是( )
| A. |  实验室制氨气 | B. |  干燥NH3 | ||
| C. |  证明氨气极易溶于水 | D. |  吸收氨气 |
18.抗酸药的种类很多,通常含有一种或几种能中和盐酸的化学物质,胃酸过多的人需要服用此类药物.则此类药中不能含有的物质是( )
| A. | 碳酸镁 | B. | 氢氧化铝 | C. | 碳酸钙 | D. | 氢氧化钠 |
15.下列化合物中的所有碳原子都一定在同一平面上的是( )
| A. | CH3(CH2)4CH3 | B. | CH3CH2CHO | ||
| C. | CH3CH=CHCH3 | D. | (CH3)3C-C≡C-CH=CHCH3 |


 ;②H→I:
;②H→I: .
. .
.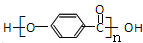 .
. 等.(任写一种)
等.(任写一种)