题目内容
12.用如图所示装置证明浓硫酸的强氧化性,并检验产物的性质.请回答:
(1)写出装置①中的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)装置②中的现象:紫色石蕊溶液变成红色,此实验证明SO2是酸性气体.
(3)装置③中的现象:产生淡黄色沉淀,体现了SO2的氧化性.
(4)装置④中的现象:溴水的颜色褪去,反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)装置⑤中的现象:品红溶液褪色,该现象证明SO2有漂白性.
(6)装置⑥中NaOH溶液的作用是吸收多余的SO2,防止SO2污染空气,反应的化学方程式为SO2+2NaOH═Na2SO3+H2O.
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫为酸性氧化物,溶于水显示酸性,能够使紫色石蕊试液变红;
(3)二氧化硫与硫化氢反应生成淡黄色的硫单质,根据化合价变化判断二氧化硫表现的性质;
(4)二氧化硫具有还原性,能够被溴单质氧化生成硫酸,所以溴水褪色,据此写出反应的离子方程式;
(5)二氧化硫具有漂白性,能够使品红溶液褪色;
(6)二氧化硫有毒,不能直接排放,二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,据此写出反应的化学方程式.
解答 解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫溶于水生成亚硫酸,亚硫酸为弱酸,所以二氧化硫溶液显示酸性,能够使紫色石蕊溶液变成红色,
故答案为:紫色石蕊溶液变成红色;酸;
(3)装置③中盛放硫化氢,硫化氢能够与二氧化硫发生氧化还原反应生成淡黄色的硫单质,二氧化硫在反应中化合价降低,表现了氧化性,
故答案为:产生淡黄色沉淀;氧化;
(4)二氧化硫具有还原性,溴单质具有氧化性,二者能够发生反应:SO2+Br2+2H2O═4H++2Br-+SO42-,所以装置④中溴水褪色,
故答案为:溴水的颜色退去;SO2+Br2+2H2O═4H++2Br-+SO42-;
(5)二氧化硫具有漂白性,能够使有色物质褪色,所以装置⑤中品红溶液褪色,
故答案为:二品红溶液褪色;漂白;
(6)二氧化硫是一种有毒气体,多余的二氧化硫不能直接排放,避免污染空气;二氧化硫能够与氢氧化钠溶液反应:SO2+2NaOH═Na2SO3+H2O,可以用氢氧化钠溶液吸收多余的二氧化硫,
故答案为:吸收多余的SO2,防止SO2污染空气;SO2+2NaOH═Na2SO3+H2O.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握浓硫酸的性质二氧化硫的性质及检验方法,试题知识点较多、充分考查了学生的分析、理解能力及化学实验能力.

| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
 )及一个氯原子,写出其结构简式并命名.
)及一个氯原子,写出其结构简式并命名. 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.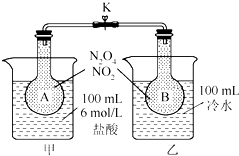 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.
如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解. $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).