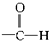题目内容
4.T1温度时,向密闭容器中通入N2O5,发生以下反应:2N2O5(g)?4NO3(g)+O2(g)△H>0,部分实验数据简下表下列说法中不正确的是( )| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
分析 A.平衡常数只受温度影响,该反应正反应是吸热反应,升高温度,平衡向正反应移动,化学平衡常数增大;
B.根据v=$\frac{△c}{△t}$计算50s内N2O5分解速率;
C.100s、150s时,N2O5的浓度都是1.25mol/L,说明100s时反应到达平衡,利用三段式计算平衡时各组分的浓度、各物质的浓度变化量,代入平衡常数表达式K=$\frac{{c}^{4}(N{O}_{2})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$计算,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%;
D.到平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,压强增大一倍,平衡向逆反应方向移动.
解答 解:A.平衡常数只受温度影响,该反应正反应是吸热反应,升高温度,平衡向正反应移动,若T1>T2,则K1>K2,故A错误;
B.50s内N2O5的浓度变化量为2.5mol/L-1.76mol/L=0.74mol/L,故N2O5分解速率为$\frac{0.74mol/L}{50s}$=1.48×10-2mol/(L•s),故B正确;
C.100s、150s时,N2O5的浓度都是1.25mol/L,说明100s时反应到达平衡,则:
2N2O5(g)?4NO2(g)+O2(g)
开始(mol/L):2.5 0 0
变化(mol/L):1.25 2.5 0.625
平衡(mol/L):1.25 2.5 0.625
故该温度下,平衡常数k=$\frac{2.{5}^{4}×0.625}{1.2{5}^{2}}$=15.625,N2O5的转化率=$\frac{1.25mol/L}{2.5mol/L}$×100%=50%,故C正确;
D.达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,若平衡不移动,则c(N2O5)=2.50mol.L-1,但压强增大一倍,平衡向逆反应方向移动,则c(N2O5)>2.50mol.L-1,故D正确,
故选A.
点评 本题考查化学反应速率计算、化学平衡影响因素、化学平衡平衡常数计算及影响因素等,难度中等,注意理解掌握外界条件对平衡移动的影响.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的$\frac{1}{2}$ | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,正反应速率减小,逆反应速率增大 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O△H<0 |
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
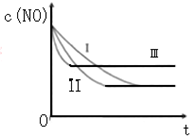 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.3.50 D.2.50
②根据①中数据计算前2s内的平均反应速率v(CO2)=3.75×10-4 mol/(L.s).
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v逆(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如如图所示:
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=160.
(5)CO可作燃料电池的燃气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650°C下工作的燃料电池.该电池总反应方程式为2CO+O2=2CO2 则负极反应式为2CO+2CO32--4e-═4CO2.
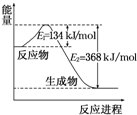 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)如图是1mol NO2和1mol CO 反应生成 CO2和NO的过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)??2NH3(g);△H<0,其化学平衡常数K与T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态依据的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)??N2(g)+3H2(g)的化学平衡常数K为2.当测得NH3、N2、H2的物质的量分别为3mol、2mol、1mol时,则该反应的v正(N2)>v逆(N2)(填“>”、“=”或“<”).
(3)氨气溶于水所得的溶液称为氨水.若某氨水的pH=12,则水电离出的c(OH-)=1×10-12mol•L-1,水的电离常数无影响(填“变大”、“变小”或“无影响”);在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
| A. |  稀盐酸 | B. |  冰水混合物 | C. |  食用醋 | D. |  液化石油气 |
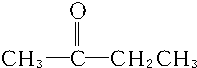 C:CH2═CH-CH2CH3或CH3CH═CH-CH3.
C:CH2═CH-CH2CH3或CH3CH═CH-CH3.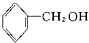 酚类-OH②
酚类-OH②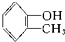 醇类-OH③
醇类-OH③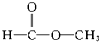 酯类
酯类
 醚类
醚类