题目内容
下列各原子或离子的电子排布式错误的是( )
| A、Al 1s22s22p63s23p1 |
| B、S2- 1s22s22p63s23p4 |
| C、Na+ 1s22s22p6 |
| D、F 1s22s22p5 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:基态原子或离子的电子应处于能量最低的状态,结合能量最低原理解答.
解答:
解:A.Al原子核外有13个电子,电子排布式为1s22s22p63s23p1,符合能量最低原理,故A正确;
B.S2-核外有18个电子,电子排布式为1s22s22p63s23p6,故B错误;
C.Na+原子核外有10个电子,核外电子排布式为1s22s22p6,故C正确;
D.F原子核外有9个电子,核外电子排布式为1s22s22p5,故D正确;
故选B.
B.S2-核外有18个电子,电子排布式为1s22s22p63s23p6,故B错误;
C.Na+原子核外有10个电子,核外电子排布式为1s22s22p6,故C正确;
D.F原子核外有9个电子,核外电子排布式为1s22s22p5,故D正确;
故选B.
点评:本题考查原子核外电子排布,题目难度不大,本题注意基态原子或离子的电子排布规律,把握书写方法.

练习册系列答案
相关题目
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列说法正确的是( )

| A、CaSO4在稀硫酸中的溶解性比在纯水中的溶解性 强 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等 于3×10-3 mol/L |
| C、d点溶液通过蒸可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
C和CuO在高温下反应可能生成Cu、Cu2O、CO2、CO.现将1g碳粉跟8g CuO混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为1.1g,残余气体在标准状况下的体积为560mL.下列说法错误的是( )
| A、在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 |
| B、试管中发生的所有氧化还原反应共转移电子0.15 mol |
| C、反应后试管中剩余的固体混合物的总质量为7.2 g |
| D、反应生成铜和氧化亚铜的总物质的量为0.1 mol |
下列物质分类正确的是( )
A、 芳香族化合物 芳香族化合物 |
B、 羧酸 羧酸 |
C、 醛 醛 |
D、 酚 酚 |
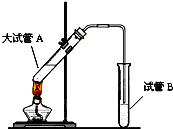 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:

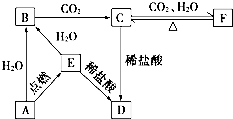 如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.
如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.