题目内容
15.试回答下列问题(温度均为25℃):(1)将0.2mol/L HB溶液与0.1mol/L MOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+)>0.2mol/L HB溶液中由水电离出的c(H+).(填“>”、“<”或“=”)
(2)pH=13的Ba(OH)2溶液a L与pH=3的HCl溶液b L混合.若所得混合溶液呈中性,则a:b=1:100.
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,得到的CO还可以用作燃料.已知某个电极的反应为:4OH--4e-=O2↑+2H2O,该电极为阳极;另一个电极的反应式为CO2+H2O+2e-=CO+2OH-.
(4)已知Ksp[Cu(OH)2]=1×10-20.要使0.2mol/L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为>6.5.
分析 (1)HB过量,反应后溶液中HB的浓度为0.05mol/L,而溶液的pH=4,说明HB只能部分电离出氢离子,则HB为弱酸,NaB为强碱弱酸盐,溶液呈碱性;将0.2mol/L HB溶液与0.1mol/L MOH溶液等体积混合,得到等浓度的HB和MB的混合溶液,测得混合溶液的pH=4,溶液显酸性,说明HB电离 程度大于B-离子水解;
(2)根据反应后溶液为中性可知:n(H+)=n(OH-),据此列式计算;
(3)失电子的电极发生氧化反应为电解池的阳极,阴极发生还原反应,CO2被还原生成CO;
(4)Cu2+沉淀较为完全浓度降至原来的千分之一,根据Ksp求出OH-离子的浓度,再求pH.
解答 解:(1)HB过量,反应后溶液中HB的浓度为0.05mol/L,而溶液的pH=4,说明HB只能部分电离出氢离子,则HB为弱酸,NaB为强碱弱酸盐,溶液呈碱性;将0.2mol/L HB溶液与0.1mol/L MOH溶液等体积混合,得到等浓度的HB和MB的混合溶液,测得混合溶液的pH=4,溶液显酸性,说明HB电离 程度大于B-离子水解,混合溶液中水电离的氢离子浓度一定大于0.2mol/L HB溶液中由水电离出的c(H+);
故答案为:>;
(2)pH=13的Ba(OH)2溶液 a L与pH=3的HCl溶液bL混合.若所得混合溶液呈中性,则:n(H+)=n(OH-),即:0.1mol/L×2×aL=0.001mol/L×2×bL,
则:a:b=1:100,
故答案为:1:100;
(3)4OH--4e-=O2↑+2H2O,该电极为阳极,另一电极为阴极发生还原反应,CO2被还原生成CO,阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:阳;2CO2+4e-+2H2O=2CO+4OH-;
(4)Cu2+沉淀较为完全时的浓度=1×10-5mol/L,
则c(OH-)=$\sqrt{\frac{1×1{0}^{-20}}{1×1{0}^{-5}}}$mol/L═10-7.5mol/L,
则c(H+)=$\frac{1{0}^{-14}}{1{0}^{-7.5}}$mol/L=10-6.5mol/L,
所以pH=-lg(10-6.5)=6.5,则应向溶液里加入NaOH溶液,调整溶液的pH范围为PH>6.5,
故答案为:>6.5
点评 本题考查了弱电解质电离平衡影响因素、酸碱反应后溶液酸碱性的判断、溶液PH计算、溶度积常数计算等知识点,掌握基础是解题关键,题目难度中等.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | BaCl2溶液产生沉淀 | B. | AgNO3溶液产生沉淀 | ||
| C. | 品红溶液褪色 | D. | 石蕊试液变红 |
| A. | 间二甲苯也称为1,4-二甲基苯 | B. | C3H6Cl2有3种同分异构体 | ||
| C. | 实验室由乙醇制备乙烯为消去反应 | D. | 所有的酯都有香味并且都易溶于水 |
| A. | Fe2+ | B. | SO42- | C. | Na+ | D. | OH- |
| A. | 少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++2HCO3-+2OH-=CaCO3+2H2O+CO32- | |
| B. | HS-的电离方程式:HS-+H2O?H3O++S2- | |
| C. | Na2CO3溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,其平衡常数的表达式为$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(Cr{{\;}_{2}O}_{7}^{2-})}$ |
| A. | 乳酸薄荷醇酯( 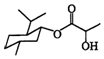 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛( 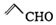 )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示二者均有三种不同的氢原子且三种氢原子数的比例相同,故不能用1H-NMR来鉴别 |
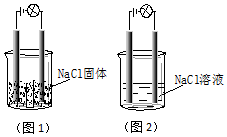 某同学在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
某同学在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水中电离出可以自由移动的离子 | |
| D. | NaCl溶液中水电离出大量的离子 |
| A. | 生石灰和水的反应 | B. | 木炭在氧气中燃烧 | ||
| C. | 三氧化硫溶于水 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
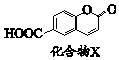
| A. | X分子式是C10H6O4 | |
| B. | X分子中有两种含氧官能团 | |
| C. | 加热条件下1 mol X最多能与2molNaOH反应 | |
| D. | 一定条件下能发生加成、水解、氧化、取代反应 |