题目内容
20.下列物质中加入NaOH溶液,不能得到澄清溶液的是( )| A. | Al(OH)3 | B. | Al2O3 | C. | H2SiO3 | D. | MgCO3 |
分析 氢氧化铝、氧化铝为两性化合物,都与氢氧化钠溶液反应,硅酸与氢氧化钠反应生成硅酸钠,碳酸镁与氢氧化钠反应生成氢氧化镁,以此解答.
解答 解:A.Al(OH)3为两性氢氧化物,可用氢氧化钠反应生成偏铝酸钠和水,得到澄清溶液,故A不选;
B.Al2O3为两性氧化物,可用氢氧化钠反应生成偏铝酸钠和水,得到澄清溶液,故B不选;
C.硅酸与氢氧化钠反应生成硅酸钠,得到澄清溶液,故C不选;
D.碳酸镁与氢氧化钠反应生成氢氧化镁,仍为浑浊溶液,故D选.
故选D.
点评 本题综合考查元素化合物知识,侧重于镁铝化合物的性质的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
2.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 NaOH H2O |
3.在水溶液中能大量共存,且加入过量稀硫酸溶液时,有气体生成的是( )
| A. | Na+ Ag+ CO32- Cl- | B. | K+ Ba2+SO42- Cl- | ||
| C. | Na+ K+ CO32- Cl- | D. | Na+ K+ Cl- SO42- |
15.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):
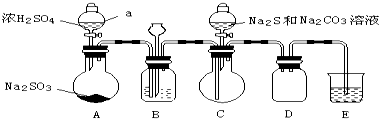
回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
(5)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.
10.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 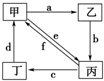 | Cu | CuO | CuCl2 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Al(OH)3 | Al2O3 | Na[Al(OH)4] | AlCl3 |
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①②③④ |


 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: ;
; .
. .
. .
.