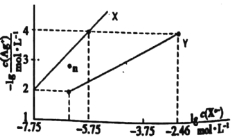
题目内容
【题目】分枝酸可用于生化研究,其结构简式如右所示。下列关于分枝酸的叙述正确的是( )

A. 可与乙醇、乙酸反应,且反应类型相同
B. 分子中含有2种官能团
C. 1mol分枝酸最多可与3mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
【答案】A
【解析】
A. 分枝酸含有羧基和羟基,羧基可以和乙醇发生酯化反应,羟基可以和乙酸发生酯化反应,酯化反应是取代反应,A正确;
B. 分枝酸含有羧基、酯基、醚键、碳碳双键这四个官能团,B错误;
C. 1个分枝酸分子中含有2个羧基,不含酚羟基(注意六元环不是苯环),1mol分枝酸最多可与2mol NaOH发生中和反应,C错误;
D. 分枝酸可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但是二者原理不同:与溴反应是加成反应,与酸性高锰酸钾溶液发生氧化还原反应,D错误;
故合理选项为A。

【题目】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲线c对应的温度是_____。
②关于工业合成氨的反应,下列叙述正确的是_____(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________。
②该反应的化学平衡常数表达式是_____。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____。
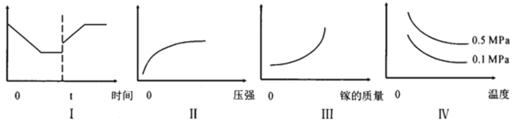
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____。